Benzol – Strukturformel, Mesomerie und Reaktivität
Erfahre mehr über den aromatischen Kohlenwasserstoff Benzol, seine Stabilität, Aromatizität, Valenzisomere und Reaktivität. Finde heraus, warum Benzol reaktionsträge ist und wie die elektrophile Substitution erfolgt.
Inhaltsverzeichnis zum Thema Benzol
Teste dein Wissen
Welches Grundgerüst bildet Benzol?
Frage 1 von 5
Was ist eine charakteristische Eigenschaft von Aromaten?
Frage 2 von 5
Was bedeutet Mesomeriestabilisierung?
Frage 3 von 5
Wie reagiert Benzol generell auf elektrophile Substitution?
Frage 4 von 5
Was geschieht bei der Reaktion von Benzol mit Sauerstoff?
Frage 5 von 5
Der Benzolring
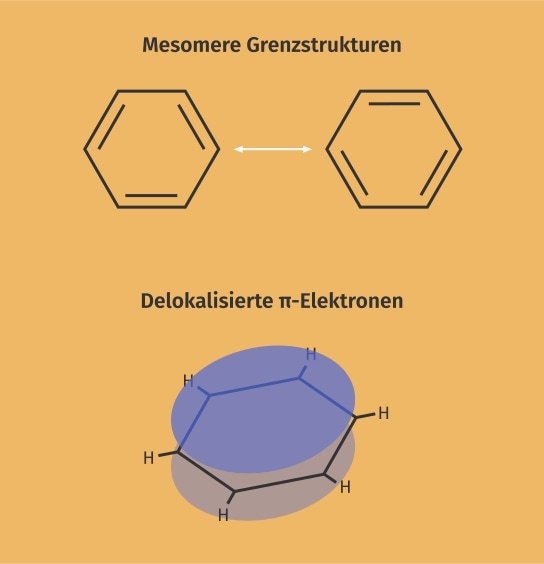
Benzol gehört zur Stoffgruppe der Kohlenwasserstoffe. Es wird selten auch Benzen genannt. Das Grundgerüst des Benzols (C6H6) wird aus sechs ringförmig angeordneten Kohlenstoffatomen gebildet. Seine Struktur ähnelt damit der Strukturformel des Cyclohexans. Allerdings haben die Kohlenstoffatome des Benzols im Gegensatz zu denen des Cyclohexans sp2–hybridisierte Kohlenstoffatome statt sp3–hybridisierte. Dementsprechend hat ein einzelnes Kohlenstoffatom drei sp2-Orbitale und ein freies p-Orbital. Die drei sp2-Orbitale liegen alle auf einer Ebene und bilden zwei sp2-sp2-σ-Bindungen zu ihren benachbarten Kohlenstoffatomen und eine sp2-s-σ-Bindung zu einem Wasserstoffatom aus. Das übrige p-Orbital steht senkrecht zur Bindungsebene der σ-Bindungen. Die p-Orbitale benachbarter Kohlenstoffatome können miteinander wechselwirken und π-Bindungen ausbilden. Da für eine π-Bindung immer zwei p-Orbitale miteinander wechselwirken müssen, könnte man hinsichtlich der Struktur des Benzols davon ausgehen, dass es sich um einen Ring aus sich abwechselnden Einfach- und Doppelbindungen handelt. Da aber alle Bindungslängen des Benzolrings gleich lang sind, müsste man davon ausgehen, dass die Doppelbindungen innerhalb des Rings schnell hin- und herwechseln (mesomere Grenzformeln). Tatsächlich sind die π-Bindungselektronen des Benzols nicht innerhalb von Doppelbindungen lokalisiert, sondern bilden durch die stetig benachbarten p-Orbitale eine π-Elektronenwolke oberhalb und unterhalb des Sechsrings. Die folgende Abbildung zeigt neben der Skelettformel des Benzols auch die delokalisierten Elektronen über und unter der Ringebene.
Die Stabilität des Benzols
Die Bromierung von Benzol kann nicht wie für andere Alkene mit Brom in einer einfachen Additionsreaktion ablaufen. Dies liegt daran, dass das Benzol eine besonders stabile Struktur hat und damit reaktionsträge ist. Die Stabilität des Benzols kommt durch die oben genannte Möglichkeit zustande, die Doppelbindungen des Benzols in seiner Lewisformel auf zwei verschiedene Arten in den Ring einzuzeichnen. Durch dieses Vorhandensein von mesomeren Grenzstrukturen erfährt das Benzol die sogenannte Mesomeriestabilisierung.
Per Definition beschreibt die Mesomerie, dass die reale Struktur eines Moleküls nicht durch eine einzige Lewisformel dargestellt werden kann. Die Mesomerie ist in der Chemie ein wichtiger Faktor zur Stabilisierung von Molekülen.
Aromatizität
Die Möglichkeit zur Mesomeriestabilisierung des Benzolrings ist auf seine planare Struktur zurückzuführen. Die Planarität eines ringförmigen, konjugierten Kohlenstoffgerüsts ist von der Anzahl seiner delokalisierten π-Elektronen abhängig. Moleküle, die ebene Ringe mit einer geschlossenen Elektronenwolke sind, nennt man Aromaten. Neben diesen Eigenschaften müssen Aromaten außerdem die Hückel-Regel erfüllen. Diese besagt, dass ein ebener Ring mit geschlossener Elektronenwolke aromatisch ist, wenn er insgesamt 4n + 2 Elektronen besitzt (n = 0, 1, 2, 3 …).
Benzol – Eigenschaften und Steckbrief
In der folgenden Tabelle sind einige wichtige Eigenschaften wie zum Beispiel die Siedetemperatur des Benzols und seine molare Masse aufgelistet. Dabei fällt auf, dass der Siedepunkt des Benzols sehr nah an dem des Cyclohexans liegt. Die Aromatizität beeinflusst also nicht die intermolekularen Wechselwirkungen.
| Summenformel | C6H6 |
|---|---|
| molare Masse | 78,11 g/mol |
| Siedetemperatur | 80 °C |
| Schmelztemperatur | 6 °C |
| Dichte | 0,88 g/cm3 |
| Gefahren | leicht entzündlich, gesundheitsgefährdend |
Die Gewinnung von Benzol erfolgt zum Beispiel durch Steamcracken, katalytisches Reforming oder die Transalkylierung. Weitere Vorkommen von Benzol sind zum Beispiel Erdöl und Erdgas.
Benzol dient als Ausgangssubstanz für verschiedene Stoffe und wird für ihre Synthese eingesetzt. Die Verwendung von Benzol als Lösungsmittel wird heutzutage aufgrund seiner Giftigkeit möglichst vermieden.
Valenzisomere des Benzols
Valenzisomere sind Konstitutionsisomere, die die gleiche Summenformel haben, aber sich durch die Anzahl und Position ihrer σ- und π-Bindungen unterscheiden. Valenzisomere des Benzols sind das Dewar-Benzol, Benzvalen, Prisman und Bicyclopropenyl.
Die Reaktivität des Benzols
Generell ist Benzol eher reaktionsträge. Eine gut ablaufende Reaktion ist allerdings die elektrophile Substitution des Benzols. Dazu zählen neben der Chlorierung von Benzol mit Chlor und Aluminiumchlorid auch die Nitrierung und Sulfonierung von Benzol mit Nitriersäure bzw. Schwefelsäure. Der Reaktionsmechanismus für die Chlorierung von Benzol ist in der folgenden Abbildung als Stellvertreter für die elektrophile Substitution am Benzol gezeigt. Die Generierung des Elektrophils variiert mit der einzuführenden Gruppe.

Zu Beginn geht das Elektrophil mit den delokalisierten π-Elektronen eine Wechselwirkung ein und bildet dabei den π-Komplex. Stellt man sich nun das Benzol mit lokalisierten Doppelbindungen vor, kann eine dieser Doppelbindungen das Elektrophil nukleophil angreifen. Dabei entsteht der positiv geladene σ-Komplex. Dieser ist durch die Delokalisierung der positiven Ladung innerhalb des Kohlenstoffrings stabilisiert. Durch das Entfernen des Wasserstoffatoms an dem Kohlenstoffatom, das nukleophil angegriffen wurde, entsteht so ein ungeladenes, substituiertes Benzolderivat, Chlorbenzol.
Eine weitere Variante der elektrophilen aromatischen Substitution ist die Friedel-Crafts-Alkylierung von Benzol, bei der der Benzolring direkt alkyliert wird. Dabei entsteht zum Beispiel durch die Umsetzung von Benzol mit Chlorethan und Aluminiumchlorid Ethylbenzol.
Wie alle anderen Kohlenwasserstoffe lässt sich Benzol außerdem sehr gut verbrennen. Bei der Verbrennung von Benzol reagiert das Molekül mit Sauerstoff zu Kohlenstoffdioxid und Wasser.
Häufig gestellte Fragen zum Thema Benzol

