Kalk: Chemie, Bestandteile und Verwendung
Entdecke die Vielfalt von Kalk! Chemisch betrachtet Calciumcarbonat, hat Kalk zahlreiche Anwendungen in Medizin, Bau und Industrie. Lerne mehr über den natürlichen und technischen Kalkkreislauf sowie die Herstellung von Branntkalk und Löschkalk. Interessiert? Dies und vieles mehr findest du im folgenden Text.
Inhaltsverzeichnis zum Thema Kalk
Kalk: Definition
Der Begriff Kalk wird umgangssprachlich zur Bezeichnung unterschiedlicher Stoffe benutzt. Einerseits ist damit der Kalkstein gemeint, der in der Natur meist in der mineralischen Form von Calcit (Kalkspat) oder Aragonit vorliegt. Chemisch gesehen handelt es sich bei Kalk um Calciumcarbonat. Die chemische Formel von Kalk lautet ![]() .
.
Es gibt den natürlichen und den technischen Kalkkreislauf. Die beiden Kreisläufe sind miteinander verwandt, da in beiden Calciumcarbonat (Kalk), im Mittelpunkt steht.
Calciumcarbonat: Verwendung und Herstellung
Die Gewinnung von synthetischem Calciumcarbonat wird durch das Einleiten von Kohlenstoffdioxid in Kalkmilch (Calciumhydroxid) erreicht. Die Anwendungsgebiete von Calciumcarbonat sind vielfältig. Es wird zum Beispiel in der Medizin zur Vorbeugung und Therapie von Calciummangel und als Antacidum gegen Sodbrennen und saures Aufstoßen eingesetzt. Calciumcarbonat wird auch in der Lebensmittelbranche als Zusatzstoff (E170) verwendet. Zumeist als Lebensmittelfarbstoff, aber auch als Füllstoff oder Rieselhilfe wird Calciumcarbonat eingesetzt. Ein weiteres Anwendungsgebiet findet sich in der chemischen Industrie und der Bauindustrie. Hier wird es als Roh- und Füllstoff eingesetzt.
Der natürliche Kalkkreislauf
Der natürliche Kalkkreislauf beschreibt die Wanderung der Calciumionen in der Natur. Die Calciumionen können dabei sowohl gelöst als auch in gebundener Form auftreten.
In der folgenden Abbildung sind einige wichtige Vorgänge des natürlichen Kalkkreislaufes übersichtlich dargestellt.

Kalkstein, Kreide und Marmor
Kalkstein stellt eine Ionenverbindung dar, die in verschiedenen Formen in der Natur vorkommt. Marmor und Kreide sind spezielle Formen des Calciumcarbonats. In der folgenden Tabelle sind die Bestandteile von Kreide, Kalkstein und Marmor aufgeführt.
| Kreide | Kreide ist ein feines Sedimentgestein, das durch Ablagerung von gefälltem Calcit sowie der Schalen von fossilen Kleinlebewesen entstanden ist. |
| Kalkstein | Kalkstein wird überwiegend von Lebewesen gebildet und ist stärker verfestigt als Kreide. Die Kalkablagerung geschieht aus den Überresten der Lebewesen die Calciumcarbonat zum Aufbau von Außen- oder Innenskeletten abscheiden. |
| Marmor | Marmor ist ein metamorphes Gestein, das entsteht, wenn Kreide, Kalkstein oder Dolomit unter dem Einfluss hoher Temperaturen und/oder hoher Drücke umkristallisiert werden. |
Die Farbe von Kalkstein ist hell, weiß bis ocker-farbig. Sie richtet sich nach dem Gehalt an Mangan- und Eisenoxiden sowie anderen farbigen Mineralien. Kalk neutralisiert im Boden in erster Linie überschüssige Säuren und erhöht damit den pH-Wert.
Tropfsteinhöhle: Chemie und Entstehung
Calciumcarbonat ist in reinem Wasser kaum löslich. Wird im Wasser jedoch Kohlenstoffdioxid (![]() gelöst, wandelt sich Calciumcarbonat mit der dabei entstehendenKohlensäure zu wasserlöslichem Calciumhydrogencarbonat um. Die dabei entstehenden Calciumionen bestimmen übrigens die Wasserhärte. Die Reaktion von Calciumcarbonat und Wasser, in welchem Kohlenstoffdioxid gelöst ist, ist in der folgenden Reaktionsgleichung dargestellt:
gelöst, wandelt sich Calciumcarbonat mit der dabei entstehendenKohlensäure zu wasserlöslichem Calciumhydrogencarbonat um. Die dabei entstehenden Calciumionen bestimmen übrigens die Wasserhärte. Die Reaktion von Calciumcarbonat und Wasser, in welchem Kohlenstoffdioxid gelöst ist, ist in der folgenden Reaktionsgleichung dargestellt:
![]()
Denselben Effekt findet man auch bei der Bildung von Tropfsteinen. Sie entstehen immer dann, wenn versickerndes Wasser durch die Bodenhorizonte mit Kohlenstoffdioxid (![]() ) angereichert wird und dabei den im Gestein befindlichen Kalk (
) angereichert wird und dabei den im Gestein befindlichen Kalk (![]() löst. Wenn das Wasser verdunstet, bleibt der gelöste Kalk zurück und lagert sich ab. Dadurch bilden sich sogenannte Tropfsteine (kristalliner Kalkstein).
löst. Wenn das Wasser verdunstet, bleibt der gelöste Kalk zurück und lagert sich ab. Dadurch bilden sich sogenannte Tropfsteine (kristalliner Kalkstein).
Der technische Kalkkreislauf: Branntkalk und Löschkalk
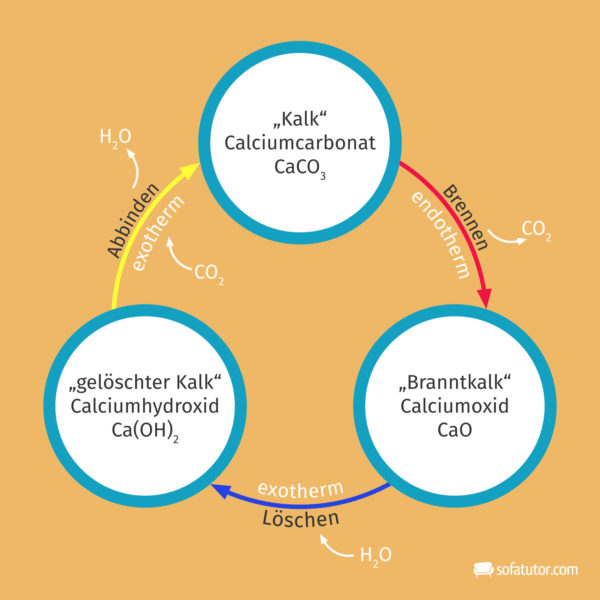
Der Technische Kalkkreislauf stellt die technische Umwandlung von natürlichem Kalkstein in den folgenden drei Schritten dar:
| Technischer Kalkkreislauf | Reaktionsgleichung | Produkt |
|---|---|---|
| 1. Schritt: Das Brennen | Branntkalk (Calciumoxid, |
|
| 2. Schritt: Das Löschen | Löschkalk (Calciumhydroxid, |
|
| 3. Schritt: Das Abbinden | Kalk (Calciumcarbonat, |
Ziel ist die Bereitstellung von Kalk als Baustoff. In der folgenden Abbildung sind die Prozesse des technischen Kalkkreislaufes noch einmal übersichtlich dargestellt.
Branntkalk: Formel und Verwendung
Branntkalk wird auch als gebrannter Kalk oder ungelöschter Kalk bezeichnet. Branntkalk besteht aus Calciumoxid mit der Formel ![]() . Es ist ein weißgraues Pulver, das auf Schleimhäute und Augen stark ätzend wirkt.
. Es ist ein weißgraues Pulver, das auf Schleimhäute und Augen stark ätzend wirkt.
Bei der Herstellung von Branntkalk wird Calciumcarbonat (Kalkstein) stark erhitzt. Dabei entstehen Calciumoxid und Kohlenstoffdioxid.
Die Verwendung von Calciumoxid (ungelöschter Kalk) liegt vor allem in der Bauindustrie. Dort dient er zur Herstellung von Mörtel sowie für die Produktion von Kalksandstein, Zementklinkern und Kalkfarbe.
Löschkalk: Verwendung und Herstellung
Bei der Herstellung von Löschkalk wird Calciumoxid (Branntkalk) in Wasser eingerührt. Dabei entwickelt sich Hitze. Man nennt diesen Vorgang auch Kalklöschen. Als Produkt entsteht Calciumhydroxid mit der Formel ![]() . Durch das Kalklöschen kann man also Löschkalk herstellen.
. Durch das Kalklöschen kann man also Löschkalk herstellen.
Auch Löschkalk wirkt stark ätzend auf Augen und Schleimhäute. Gelöschter Kalk findet Verwendung in der Bauindustrie und bei der Herstellung von Mörtel.
Im verarbeiteten Mörtel findet ein besonderer Prozess statt, der als Abbinden bezeichnet wird. Beim Abbinden reagiert Calciumhydroxid mit dem Kohlenstoffdioxid in der Luft. Im Ergebnis dieser Reaktion entsteht Calciumcarbonat (Kalkstein).
Häufig gestellte Fragen zum Thema Kalk

