Isotope – Definition, Beispiele und Anwendungen
Lerne, wie Isotope Atomkerne desselben Elements mit unterschiedlicher Masse unterscheiden. Entdecke die Bedeutung von stabilen und instabilen Isotopen sowie ihre vielfältigen Anwendungen in der Wissenschaft. Interessiert? Dies und mehr findest du im folgenden Text!
Inhaltsverzeichnis zum Thema Isotope
Isotope – Erklärung
Am einfachsten lassen sich Isotope erkennen, wenn die Massenzahl des Kerns betrachtet wird. Die Kernladungszahl Z und damit die Anzahl der Protonen eines Atomkerns ist für jedes Element charakteristisch und immer gleich. Allerdings kann die Masse verschiedener Atomkerne des gleichen Elements unterschiedlich sein. Dies lässt sich durch eine unterschiedliche Anzahl an Neutronen im Atomkern erklären. Atome des gleichen Elements, die sich in ihrer Massenzahl A unterscheiden, nennt man Isotope.
Schreibweisen von Isotopen
Eine abkürzende Schreibweise für Isotope ist die Notation als Formelzeichen. Hier wird links neben das Atomsymbol des Atoms X oben die Massenzahl A und unten die Kernladungszahl Z notiert. Ein Beispiel hierfür ist in der folgenden Abbildung gezeigt. Hier ist das Kohlenstoffisotop mit der Massenzahl 14 abgebildet.
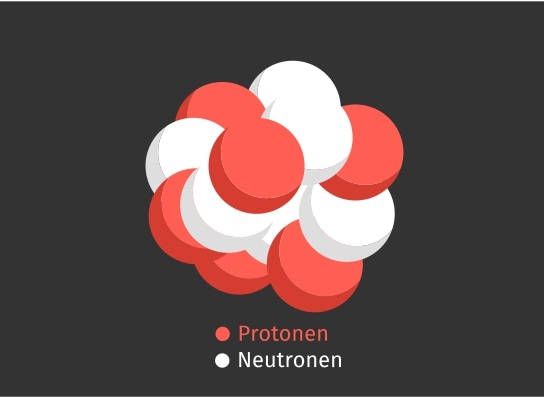
Das Kohlenstoff-14-Isotop zur Veranschaulichung der Notation als Formelzeichen. N gibt die Anzahl der Neutronen an.
Der Kern des Kohlenstoffatoms hat eine Kernladungszahl von Z = 6 und eine Masse von A = 14. Entsprechend wird das Atomsymbol C mit diesen beiden Werten notiert.
In einem Fließtext kann allerdings auch eine andere Schreibweise verwendet werden. Hier wird der Name des Elements ausgeschrieben und nur die Massenzahl A des Isotops dahinter notiert. Für das vorangegangene Beispiel wäre diese Schreibweise also: Kohlenstoff-14. Alternativ kann der Elementname auch durch das Elementsymbol abgekürzt werden: C-14.
Beispiele für die Isotope eines Elements
Das leichteste Isotop im Periodensystem ist Wasserstoff-1. Sein Atomkern besteht aus einem Proton. Weitere Isotope des Wasserstoffs sind Wasserstoff-2 (Deuterium) und Wasserstoff-3 (Tritium). Der Atomkern des Deuteriums besteht aus einem Proton und einem Neutron und der Atomkern des Tritiums aus einem Proton und zwei Neutronen. Die Wasserstoffisotope haben also alle die gleiche Kernladungszahl, aber durch die unterschiedliche Anzahl an Neutronen eine unterschiedliche Massenzahl.
Auch Kohlenstoff hat mehrere Isotope. Zwei Isotope des Kohlenstoffs sind stabil: Kohlenstoff-12 und Kohlenstoff-13. Kohlenstoff-14 ist instabil und ein Produkt aus dem radioaktiven Zerfall anderer Kerne.
In der folgenden Tabelle sind einige Beispiele für verschiedene Isotope aufgelistet.
| H | C | N | O | Cu | Sn | U |
|---|---|---|---|---|---|---|
| H-1, H-2, H3 |
C-12, C-13, C-14 |
N-14, N-15 |
O-16, O-17, O-18 |
Cu-63, Cu-65 |
Sn-112, Sn-114, Sn-115, Sn-116, Sn-117, Sn-118, Sn-119, Sn-120, Sn-122, Sn-124 |
U-238, U-235, U-234 |
Unterscheidung von Isotopen
Elemente können je nach Merkmal in verschiedene Gruppen unterteilt werden. Zuvor kann aber bereits das gesamte Periodensystem in zwei Gruppen geteilt werden: Mischelemente und Reinelemente. Als Mischelemente werden Elemente bezeichnet, von denen es zwei oder mehr Isotope gibt. Dementsprechend ist ein Reinelement ein Element, von dem es nur ein einziges Isotop gibt. Ein Beispiel für ein Reinelement ist Fluor. Fluoratome haben immer eine Massenzahl von 19.
Stabile und instabile Isotope
Die Isotope verschiedener Elemente lassen sich in stabile und instabile Isotope unterscheiden. Die Bezeichnung bestimmter Atome als radioaktiv ist auf die Stabilität ihrer Atomkerne zurückzuführen. Stabile Isotope sind nicht radioaktiv, während instabile Isotope je nach Grad der Instabilität stärker oder schwächer radioaktiv strahlen. Solche radioaktiven Isotope zerfallen aufgrund ihrer geringen Stabilität in kleinere Kerne. Ein gängiges Beispiel für ein Element mit radioaktiven Isotopen ist Uran. Uran-235 wird in Kernkraftwerken als Energieträger genutzt, da durch seinen Zerfall große Mengen an Energie frei werden.
Anwendungen für Isotope
Eine wichtige Anwendungsmöglichkeit ist die Verwendung von Isotopen für verschiedene analytische Methoden. Eine dieser Methoden ist die NMR-Spektroskopie, mit der es möglich ist, die Struktur von Molekülen zu bestimmen. Für die NMR-Spektroskopie ist es wichtig, welches Isotop eines Elements vorliegt. Da die Anzahl an Protonen und Neutronen sich auf den Kernspin auswirkt, ist die NMR-Spektroskopie nur für bestimmte Isotope eines Elements nützlich. Kohlenstoff-12 hat einen Kernspin von null und ist damit nicht im NMR sichtbar, während Kohlenstoff-13 einen Kernspin von ½ hat und somit für die NMR-Spektroskopie geeignet ist. Da die NMR-Spektroskopie eine weitverbreitete Methode zur Strukturaufklärung ist, spielen Isotope in der Chemie eine große Rolle.
Bei der Isotopenmarkierung wird an bestimmten Stellen in einem Molekül ein Atom durch ein anderes Isotop des gleichen Elements ersetzt. Dadurch können diese Stellen gezielt von anderen Atomen des gleichen Elements unterschieden werden.
Die zur Markierung verwendeten Isotope können dabei auch radioaktiv sein und so erfasst werden. Die Isotopenmarkierung wird dazu genutzt, um Reaktionsmechanismen und Stoffwechselprozesse aufzuklären, da die Position des eingefügten Isotops nachvollziehbar ist.
Speziell das Kohlenstoff-14-Isotop kann auch für die Bestimmung des Alters von kohlenstoffhaltigen Stoffen verwendet werden. Diese Methode wird Radiokarbonmethode genannt. Je älter eine Probe ist, desto geringer wird ihr Kohlenstoff-14-Gehalt.
Häufig gestellte Fragen zum Thema Isotope