Ketone – Chemie, Reaktionen und Beispiele
Entdecke die Welt der Ketone, organische Verbindungen mit vielfältigen Anwendungsmöglichkeiten als Lösungsmittel und Aromastoffe. Lerne, wie man Ketone herstellt, ihre Eigenschaften und Reaktionen versteht sowie ihre Identifizierung durch spezifische Tests. Interessiert? Dies und vieles mehr findest du im folgenden Text!
Inhaltsverzeichnis zum Thema Ketone
Wie willst du heute lernen?
Ketone – funktionelle Gruppe
Die funktionelle Gruppe der Ketone und Alkanone leitet sich von der Carbonylgruppe >C=O ab, der funktionellen Gruppe der Aldehyde und Ketone:
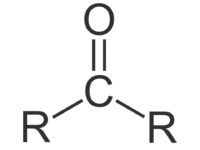
Das Sauerstoffatom ist über eine Doppelbindung an ein Kohlenstoffatom gebunden.
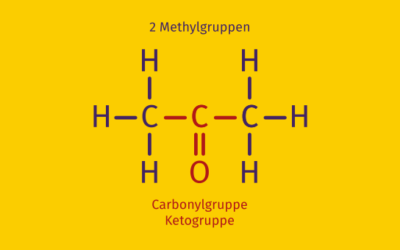
Bei den Ketonen werden beide Reste von Kohlenwasserstoffketten gebildet. In diesem Fall wird die Carbonylgruppe als Ketogruppe -C-C=(O)-C- bezeichnet. Die Ketogruppe kann also nicht endständig sein. Handelt es sich bei den Resten um gesättigte Kohlenwasserstoffe, also ohne Doppelbindungen, spricht man auch von Alkanonen. Ein Alkanon ist also immer auch ein Keton, aber nicht immer ist ein Keton ein Alkanon. Als Beispiel soll hier die Strukturformel des Ketons Propanon (Aceton) gezeigt werden, das einfachste Keton:
Ketone – Eigenschaften
Die Siedetemperatur von Ketonen liegt zwischen der von Alkanen und Alkoholen und nimmt mit steigender Kettenlänge zu. Kurzkettige Ketone sind im Wasser gut löslich. Die Löslichkeit von Ketonen nimmt mit steigender Kettenlänge ab. Außerdem sind kurzkettige Ketone leicht entzündlich.
Ketone – Reaktionen
Im Vergleich zu den Aldehyden sind Ketone stabiler und weniger reaktionsfreudig. Am häufigsten gehen Ketone Additionsreaktionen ein.
- Nucleophile Addition: Die Ketogruppe ist polar. Das Sauerstoffatom ist partiell negativ geladen, das Kohlenstoffatom partiell positiv. Am Kohlenstoffatom greifen sogenannte nucleophile Stoffe an. Ein Nucleophil ist ein Teilchen mit einem freien Elektronenpaar.
- Aldol-Addition: Reagieren zwei Ketonmoleküle in einer Additionsreaktion miteinander, entsteht ein Aldol (Aldehydalkohol).
Weiterhin können Ketone Kondensationsreaktionen eingehen.
Ketone – Nachweis
Zum Nachweis der Ketone gibt es zwei Reaktionen: die Fehlingprobe und die Silberspiegelprobe (Tollensprobe). Beide dienen generell zum Nachweis von Carbonylverbindungen. Verläuft die Reaktion positiv, liegt ein Aldehyd vor. Sind die Proben negativ, liegt ein Keton vor.
Die homologe Reihe der Ketone
Die Ketone bilden eine homologe Reihe mit der allgemeinen Summenformel für diese Ketone: CnH2nO mit n > 2. Die allgemeine Summenformel von Ketonen und Aldehyden ist identisch. Der Unterschied zwischen Aldehyden und Ketonen besteht darin, dass die funktionelle Carbonylgruppe bei Ketonen nicht endständig sein kann, bei Aldehyden jedoch schon. Benannt werden die Ketone, indem der Bezeichnung des Alkans die Endung -on angefügt wird. Vorangestellt wird dieser Endung eine Zahl, die für das Kohlenstoffatom steht, das die Ketogruppe trägt. Das einfachste Keton leitet sich vom Propan ab und trägt die Bezeichnung Propan-2-on (Aceton). Das Grundgerüst besteht aus drei Kohlenstoffatomen, leitet sich also vom Propan ab. Die Ketogruppe sitzt am zweiten Kohlenstoffatom, daher die Bezeichnung Propan-2-on. Ab dem Pentanon sind verschiedene Positionen der Ketogruppe möglich, sodass es für diese Verbindung mehrere Bezeichnungen geben kann.
In der folgenden Tabelle sind die ersten zehn Ketone als Liste mit Summenformel aufgezählt:
| Bezeichnung | Halbstruktur |
|---|---|
| Propan-2-on | CH3-C(=O)-CH3 |
| Butan-2-on | CH3-C(=O)-CH2-CH3 |
| Pentan-2-on | CH3-C(=O)-CH2-CH2-CH3 |
| Pentan-3-on | CH3-CH2-C(=O)-CH2-CH3 |
| Hexan-2-on | CH3-C(=O)-CH2-CH2-CH2-CH3 |
| Hexan-3-on | CH3-CH2-C(=O)-CH2-CH2-CH3 |
| Heptan-2-on | CH3-C(=O)-CH2-CH2-CH2-CH2-CH3 |
| Heptan-3-on | CH3-CH2-C(=O)-CH2-CH2-CH2-CH3 |
| Heptan-4-on | CH3-CH2-CH2-C(=O)-CH2-CH2-CH3 |
| Octan-2-on | CH3-C(=O)-CH2-CH2-CH2-CH2-CH2-CH3 |
| Octan-3-on | CH3-CH2-C(=O)-CH2-CH2-CH2-CH2-CH3 |
| Octan-4-on | CH3-CH2-CH2-C(=O)-CH2-CH2-CH2-CH3 |
| Nonan-2-on | CH3-C(=O)-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| Nonan-3-on | CH3-CH2-C(=O)-CH2-CH2-CH2-CH2-CH2-CH3 |
| Nonan-4-on | CH3-CH2-CH2-C(=O)-CH2-CH2-CH2-CH2-CH3 |
| Nonan-5-on | CH3-CH2-CH2-CH2-C(=O)-CH2-CH2-CH2-CH3 |
| Decan-2-on | CH3-C(=O)-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| Decan-3-on | CH3-CH2-C(=O)-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| Decan-4-on | CH3-CH2-CH2-C(=O)-CH2-CH2-CH2-CH2-CH2-CH3 |
| Decan-5-on | CH3-CH2-CH2-CH2-C(=O)-CH2-CH2-CH2-CH2-CH3 |
Häufig gestellte Fragen zum Thema Ketone









Text
Das möchte ich zu meinem Learning sagen:
siehe bei Comment
Nein
Ich dachte, bei ich gehe mal auf „Easy-Schule“, um hier „Ketone auf einfache Art erklärt zu bekommen. Aber hier
muss man schon ein Chemiker-Studium gemacht haben, um das zu verstehen. Also überhaupt nicht easy erklärt.
Hey,
es tut mir leid, wenn es zu kompliziert erklärt war. Ich versuche es kurz und einfach zusammenzufassen: Ketone sind bestimmte organische Verbindungen mit einer speziellen Gruppe (-C=O-) in der Mitte der Kohlenstoffkette. Sie entstehen, wenn man sekundäre Alkohole oxidiert.
Wenn man Ketone nachweisen will, benutzt man Tests wie die Fehlingprobe oder die Silberspiegelprobe, die zeigen, ob ein Keton vorhanden ist.
Ich hoffe, ich konnte dir damit weiterhelfen. Wenn du noch Fragen hast, lass es mich wissen!