Alkine – Chemie, Eigenschaften, Verwendung und Vorkommen
Alkine sind ungesättigte Kohlenwasserstoffe mit mindestens einer Dreifachbindung zwischen Kohlenstoffatomen. Sie sind reaktiver als Alkane und Alkene, wobei Ethin und Propin in der Industrie als Schweiß- und Schneidgase Verwendung finden. Dies und mehr erfährst du in unserem detaillierten Artikel!
Inhaltsverzeichnis zum Thema Alkine
Das Quiz zum Thema: Alkine und Kohlenwasserstoff
Was sind Alkine?
Frage 1 von 5
Wo kommen Alkine in der Natur vor?
Frage 2 von 5
Wie entstehen Alkine?
Frage 3 von 5
Wofür braucht man Alkine?
Frage 4 von 5
Kann man Alkine mehrere Dreifachbindungen haben?
Frage 5 von 5
Wie willst du heute lernen?
Alkine – Definition
Alkine sind ungesättigte Kohlenwasserstoffe mit mindestens einer Dreifachbindung zwischen zwei Kohlenstoffatomen. Es gibt auch Alkine mit zwei oder mehr Doppelbindungen. Die Doppelbindung ist die funktionelle Gruppe der Alkine. Die allgemeine Summenformel der Alkine lautet:
CnH2n-2
Die Alkine leiten sich von den Alkenen ab. Die Bildung von Alkinen erfolgt durch eine Eliminierungsreaktion: Wasserstoff wird von den Alkenen abgespalten. Daneben existieren technische Verfahren zur Synthese von Alkinen, z. B. das Sachsse-Bartholomé-Verfahren.
Alkine – Nomenklatur
Die Namen der Alkine leiten sich von den Alkanen ab. Alle Alkine haben als letzte Silbe die Endung -in. Bei der Benennung der Alkine geht man in folgenden Schritten vor:
- An die erste Silbe der Alkane wird die Endung -in angehängt. Aus Ethan wird Ethin, aus Propan wird Propin etc.
- Die Position der Dreifachbindung wird zwischen der ersten und der zweiten Silbe eingefügt: Die Nummerierung der Kohlenstoffatome erfolgt beginnend mit dem Kohlenstoffatom, das der Doppelbindung am nächsten ist. Es macht also einen Unterschied, ob beispielsweise
But-1-in (HC≡C-CH2-CH3) oder But-2-in (H3C-C≡C-CH3) vorliegt. - Eventuell vorhandene Seitenketten und Alkylreste werden dem Namen angefügt.
In der folgenden Tabelle ist die homologe Reihe der Alkine in der vereinfachten Strukturformel dargestellt. Diese Liste enthält als Beispiele die Alkine bis Oct-1-in. Die Verbindung Methin existiert nicht.
| Alkin | Formel |
|---|---|
| Ethin | CH≡CH |
| Propin | CH≡C-CH3 |
| But-1-in | CH≡C-CH2-CH3 |
| Pent-1-in | CH≡C-CH2-CH2-CH3 |
| Hex-1-in | CH≡C-[CH2]2-CH2-CH3 |
| Hept-1-in | CH≡C-[CH2]3-CH2-CH3 |
| Oct-1-in | CH≡C-[CH2]4-CH2-CH3 |
Die Struktur der Alkine und der Bindungswinkel ist linear. Als Beispiel für den räumlichen Aufbau der Alkine ist in folgender Abbildung die Molekülformel von Ethin dargestellt:
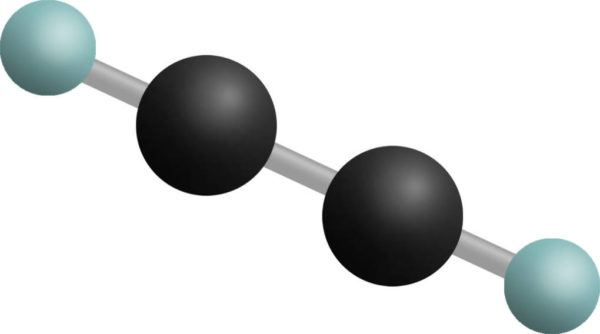
Quelle sofatutor.com
Neben normalen Isomeren kann bei Alkinen auch eine cis-trans-Isomerie auftreten.
Alkine – Steckbrief
Alkine sind unpolare Moleküle. Deswegen sind Alkine nicht wasserlöslich, sondern nur in unpolaren Lösungsmitteln löslich. Je nach Kettenlänge nehmen Alkine unterschiedliche Aggregatzustände<span style=“font-weight: 400;“> an. Die ersten drei in der Reihe der Alkine, Ethin, Propin und But-1-in, sind gasförmig, die restlichen Alkine sind flüssig. Die Kettenlänge hat ebenfalls einen Einfluss auf die Siedetemperatur und die Schmelztemperatur der Alkine. Die Siedetemperatur steigt mit zunehmender Kettenlänge an. Grund dafür ist, dass mit steigender Kettenlänge die zwischenmolekularen Kräfte zwischen den Alkinen, die sogenannten Van-der-Waals-Kräfte, stärker werden.
Ist die Dreifachbindung terminal am Alkin lokalisiert, weist das entsprechende Alkin eine geringe Acidität auf.
Alkine – Reaktionen
Alkine sind sehr reaktive Kohlenwasserstoffe. Typische Reaktionen für Alkine sind Additionsreaktionen. Bei der Addition an Alkinen wird zwischen elektrophiler und nucleophiler Addition unterschieden. Bei der Additionsreaktion wird die Dreifachbindung der Alkine aufgebrochen und andere Atome oder Moleküle angelagert. Am häufigsten findet an Alkinen eine elektrophile Addition statt. Ein Beispiel dafür ist die Halogenierung von Alkinen, z. B. eine Bromierung. Die Bromierung von Alkinen ist gleichzeitig ein Nachweis für Alkine. Ein weiteres Beispiel für eine elektrophile Addition an Alkinen ist die Hydrohalogenierung. Die Hydratisierung der Alkine, also die Addition von Wasser, führt zur Bildung von Enolen.
Wird Wasserstoff an Alkine addiert, in diesem Fall ist von einer Hydrierung die Rede, entsteht das entsprechende Alken bzw. Alkan.
Alkine – Verwendung
Von den Alkinen sind nur Ethin und Propin von wirtschaftlicher Bedeutung. Sie werden als Schweiß- und Schneidgas eingesetzt und spielen eine Rolle als Ausgangsstoff in der chemischen Industrie, z. B. bei der Herstellung von Polyvinylchlorid (PVC). In der Natur kommen Alkine nur sehr selten vor. Sie sind z. B. Bestandteil des Gifts von Pfeilgiftfröschen.
Alkane, Alkene und Alkine in der Übersicht
Die Chemie der Alkane, Alkene und Alkine weist sowohl Gemeinsamkeiten als auch Unterschiede auf.
Die folgende Tabelle enthält eine Zusammenfassung und einen Vergleich über die wichtigsten Eigenschaften der Alkane, Alkene und Alkine.
| Alkane | Alkene | Alkine | |
|---|---|---|---|
| allgemeine Summenformel | CnH2n+2 | CnH2n | CnH2n-2 |
| Nomenklatur | Vorsilbe +an | Vorsilbe + en | Vorsilbe +in |
| funktionelle Gruppe | keine/Einfachbindung | Doppelbindung | Dreifachbindung |
| räumliche Struktur | Tetraeder | trigonal-planar | linear |
| typische Reaktionen | radikalische Substitution | elektrophile und radikalische Addition; Polymerisation | elektrophile und nucleophile Addition |
| einfachster Kohlenwasserstoff | Methan | Ethen | Ethin |
Häufig gestellte Fragen zum Thema Alkine








Alle Artikel aus dem Fach Chemie