Oxidation in der Chemie einfach erklärt – Definition, Bedeutung und Beispiele
Erfahre mehr über Oxidation in der Chemie! Oxidation ist nicht nur Sauerstoffaufnahme – es geht um Elektronenabgabe und Reduktion. Entdecke Oxidationen mit und ohne Sauerstoff, in der organischen Chemie und ihre Bedeutung in Redoxreaktionen.
Inhaltsverzeichnis zum Thema Oxidation
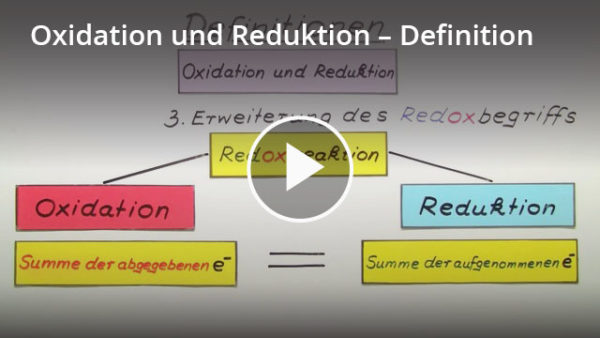
Definition von Oxidation
Häufig wird der Begriff Oxidation mit einer Sauerstoffaufnahme oder Verbrennung gleichgesetzt. Das ist in der modernen Chemie nicht mehr korrekt. Eine Oxidation ist eine Abgabe von Elektronen. Durch eine Oxidation steigt die Oxidationszahl des oxidierten Stoffs an, er ist also positiver geladen. Gleichzeitig findet eine Reduktion statt: Ein anderer Stoff nimmt die Elektronen auf. Oxidation und Reduktion laufen also gleichzeitig ab, es findet eine Redoxreaktion
| Vorgang | Gleichung |
|---|---|
| Oxidation: Stoff A gibt ein Elektron ab. | |
| Reduktion: Stoff B nimmt ein Elektron auf. | |
| Redoxreaktion |
Oxidationen – Reaktionsgleichungen
Im Folgenden werden einige Beispiele für Oxidationen erläutert.
Oxidationen durch Sauerstoff
Metalle können durch Sauerstoff in feuchter Umgebung oxidiert werden. Dieser Vorgang ist unter dem Begriff Rosten bekannt. Beispielsweise wird Eisen ![]() zu Eisenhydroxid
zu Eisenhydroxid ![]() oxidiert:
oxidiert:
![]()
Bei der Oxidation von Wasserstoff mit Sauerstoff entsteht in einer als Knallgasreaktion bezeichneten Reaktion Wasser:
![]()
Alle kohlenstoffhaltigen Verbindungen werden durch Sauerstoff zu Kohlenstoffdioxid ![]() verbrannt. Das ist sowohl bei fossilen Energieträgern wie Kohle, Erdgas und Erdöl als auch bei biochemischen Stoffwechselprozessen zur Energiegewinnung der Fall:
verbrannt. Das ist sowohl bei fossilen Energieträgern wie Kohle, Erdgas und Erdöl als auch bei biochemischen Stoffwechselprozessen zur Energiegewinnung der Fall:
![]()
Oxidationen ohne Sauerstoff
Bei der Entstehung von Kochsalz (Natriumchlorid; ![]() ) wird Natrium oxidiert und Chlor reduziert. Sauerstoff ist nicht beteiligt:
) wird Natrium oxidiert und Chlor reduziert. Sauerstoff ist nicht beteiligt:
![]()
Oxidationen in der organischen Chemie
Wichtige Stoffklassen in der organischen Chemie sind Aldehyde, Ketone und Carbonsäuren. Formal gesehen werden diese durch Oxidationen von Alkoholen gebildet. Durch die Oxidation primärer Alkohole entstehen Aldehyde, die weiter zu Carbonsäuren oxidiert werden können. Ketone werden durch Oxidation sekundärer Alkohole gebildet und können nicht weiter oxidiert werden.
Häufig gestellte Fragen zum Thema Oxidation in der Chemie