Katalysator – Definition, Eigenschaften und Wirkungsweise
Katalysatoren erhöhen die Reaktionsgeschwindigkeit, ohne selbst verbraucht zu werden. Entdecke, wie sie die Aktivierungsenergie senken und die Selektivität steigern. Katalysatoren kommen in der Chemie, Industrie und sogar im Alltag vor. Interessiert? Dies und vieles mehr findest du im folgenden Text!
Inhaltsverzeichnis zum Thema Katalysator
Katalysator – Definition
Ein Katalysator wird in der Chemie dazu verwendet, die Geschwindigkeit einer Reaktion zu erhöhen. Katalysierte Reaktionen spielen nicht nur im Labor eine große Rolle, sondern auch bei vielen biologischen Prozessen. Biologische Katalysatoren sind zum Beispiel Enzyme. Im Labor werden häufig Metalle, Metallkomplexe und organische Moleküle verwendet.
Eine wichtige Eigenschaft, die einen Katalysator auszeichnet, ist, dass er zwar an der Reaktion beteiligt ist, aber am Ende immer wieder regeneriert wird. Ein Katalysator verändert die Produkte und Edukte einer Reaktion nicht. So kann ein einzelnes Molekül des Katalysators mehrere Einzelreaktionen katalysieren und der Katalysator durchläuft so mehrere katalytische Zyklen.
Wirkungsweise eines Katalysators
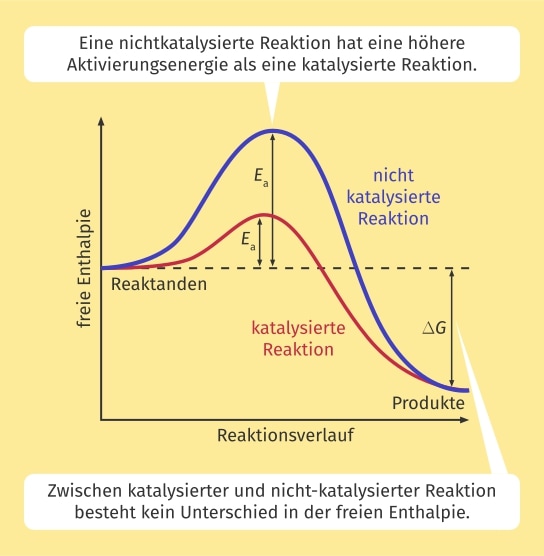
Die Funktionsweise eines Katalysators lässt sich anhand eines Energiediagramms erklären. Bei einer chemischen Reaktion wird immer ein energetisch ungünstiger Übergangszustand durchlaufen. Dieser liegt im Energiediagramm auf einem Maximum. Das liegt daran, dass die meisten Reaktionen nicht spontan ablaufen, sondern erst Energie von außen zugeführt werden muss, damit die Reaktanden, also die Stoffe, die an der Reaktion beteiligt sind, miteinander reagieren. Die Differenz zwischen der Energie der Reaktanden und der Energie des Übergangszustands ist die Aktivierungsenergie. Sie muss dem System zugeführt werden, um die Reaktion zu ermöglichen.
Bei steigender Aktivierungsenergie sinkt die Reaktionsgeschwindigkeit exponentiell, während sie bei sinkender Aktivierungsenergie exponentiell ansteigt.
Diesen Umstand macht sich die Katalyse zunutze. In einer katalytischen Reaktion wird die Aktivierungsenergie abgesenkt. Damit steigt die Reaktionsgeschwindigkeit. Das Absenken der Aktivierungsenergie ist in der folgenden Abbildung dargestellt. Das Energiediagramm mit Katalysator ist in Rot eingezeichnet, das ohne Katalysator in Blau.
Wichtig ist, dass ein Katalysator bei einer chemischen Reaktion nur kinetische Parameter verändert, aber niemals thermodynamische. So wird zum Beispiel ein Reaktionsgleichgewicht durch einen Katalysator niemals verschoben, aber dessen Einstellung beschleunigt.
Katalysatoren beschleunigen nicht alle Reaktionen gleich gut. Sie sind selektiv für bestimmte Reaktionen oder Reaktionstypen. Außerdem können sie auch spezifisch für ein bestimmtes Substrat oder Molekül sein. Durch seine Selektivität und Spezifität hat ein Katalysator auch die Funktion, gezielt Nebenreaktionen und Nebenprodukte einer Reaktion zu vermeiden. Hierdurch wird die Ausbeute erhöht und es wird weniger Abfall produziert.
Die Bedeutung von Katalysatoren
Katalysatoren finden in vielen verschiedenen Bereichen Anwendung. Sie werden sowohl für chemische Reaktionen im Labor und in der Industrie als auch für alltägliche Anwendungen benötigt. Außerdem sind an fast allen biologischen Prozessen, die das Leben ermöglichen, Enzyme als Katalysatoren beteiligt.
Arten von Katalysatoren
Katalysatoren lassen sich in verschiedene Gruppen einteilen. Zum Beispiel gibt es die Einteilung in homogene und heterogene Katalysatoren. Ein homogener Katalysator liegt in der gleichen Form wie die Reaktanden vor. Sind die Reaktanden zum Beispiel in einem Lösungsmittel gelöst, liegt auch der homogene Katalysator im gelösten Zustand vor. Ein heterogener Katalysator hingegen liegt in einem anderen Zustand als die Reaktanden vor. Ein Beispiel hierfür sind gasförmige Reaktanden, die an der Oberfläche eines festen Katalysators miteinander reagieren.
Eine weitere Möglichkeit zur Einteilung von Katalysatoren ist die Zuordnung zu den anorganischen oder organischen Katalysatoren. Anorganische Katalysatoren sind Stoffe aus der anorganischen Chemie oder auch metallorganische Komplexe. Dies können zum Beispiel Oxide wie Aluminiumoxid, Metalle wie Platin oder Metallkomplexe wie der Wilkinson-Katalysator sein. Organische Katalysatoren sind organische Moleküle, die eine katalytische Wirkung zeigen. Beispiele für organische Katalysatoren sind kleinere organische Moleküle wie das 4-(Dimethylamino)pyridin (DMAP), aber auch große organische Molekülkomplexe wie Enzyme und Ribozyme.
Wichtige Katalysatoren
Katalysatoren werden für sehr viele verschiedene Prozesse verwendet. In der folgenden Tabelle sind einige wichtige Prozesse mit ihren zugehörigen Katalysatoren dargestellt.
| Prozess | Katalysator |
|---|---|
| Haber-Bosch-Verfahren zur Herstellung von Ammoniak | ⍺-Eisen aus einem Mischkatalysator |
| Hydroformylierung | Cobaltcarbonyl(hydrid) |
| alkoholische Gärung | Hefen: Alkoholdehydrogenase (Enzym) |
| Ostwald-Verfahren zur Herstellung von Salpetersäure | Platin/Rhodium-Katalysator |
| Shell-Higher-Olefins-Prozess zur Herstellung von Olefinen | Nickel-Phosphin-Komplexe |
Katalysatoren im Alltag
Ein gut bekannter Katalysator ist der Katalysator im Auto, dessen Funktion darin besteht, die Schadstoffe in den Abgasen zu minimieren. Bestandteile von diesem Katalysator sind Platin, Palladium und Rhodium. Diese Metalle können verschiedene Oxidationen und Reduktionen katalysieren, um die Schadstoffe zu weniger gefährlichen Stoffen umzusetzen.
Negative Katalysatoren
Bisher wurden nur positive Katalysatoren behandelt. Ein positiver Katalysator katalysiert per Definition dadurch, dass er die Aktivierungsenergie herabsetzt. Es gibt aber auch negative Katalysatoren. Diese erhöhen die Aktivierungsenergie einer Reaktion und verlangsamen sie so. Dies kann nützlich sein, um sehr heftige Reaktionen besser zu kontrollieren.
Häufig gestellte Fragen zum Thema Katalysator in Chemie

