Enzymreaktion – Ablauf, Hemmung und Beispiele
Entdecke, wie Enzyme als Biokatalysatoren chemische Reaktionen beschleunigen. Lerne, wie Enzyme und ihre Substrate interagieren, die spezifische Wirkungsweise von Enzymen und die drei Arten der Hemmung enzymatischer Reaktionen. Interessiert? Dies und vieles mehr findest du im folgenden Text.
Inhaltsverzeichnis zum Thema Enzymreaktion
Was sind Enzyme?
Frage 1 von 5
Was ist für den Start einer Enzymreaktion erforderlich?
Frage 2 von 5
Welches Modell beschreibt die Anpassung eines Enzyms an sein Substrat?
Frage 3 von 5
Wie beeinflussen Enzyme eine chemische Reaktion?
Frage 4 von 5
Was bestimmt die Substratspezifität eines Enzyms?
Frage 5 von 5
Enzyme – Definition
Enzyme sind komplexe Biomoleküle, die typischerweise aus Aminosäuren aufgebaut sind. Es handelt sich also um Proteine, die durch ihren spezifischen Aufbau chemische Reaktionen katalysieren können (Biokatalysatoren). Enzyme sind an fast allen biochemischen Prozessen beteiligt und tragen somit einen großen Teil zur Aufrechterhaltung des Lebens bei. Eine Unterklasse der Enzyme sind die Ribozyme. Sie sind nicht aus Aminosäuren, sondern aus RNA-Basen aufgebaut und waren maßgeblich an der Entstehung des Lebens beteiligt.
Der Ablauf einer Enzymreaktion
Enzymreaktionen sind chemische Reaktionen, die durch Enzyme katalysiert werden. Wie auch andere Katalysatoren senkt das Enzym die Aktivierungsenergie einer Reaktion und kann diese so um ein Vielfaches beschleunigen.
Enzyme und ihre Substrate
Zu Beginn des Ablaufs einer enzymatischen Reaktion müssen zunächst das Enzym und sein Substrat aufeinandertreffen. Dabei bildet sich der sogenannte Enzym-Substrat-Komplex. Ein charakteristisches Merkmal von Enzymen ist hier die Substratspezifität. Dies bedeutet, dass ein Enzym nur mit ganz bestimmten Substraten den Enzym-Substrat-Komplex bildet. Hinsichtlich der Substratspezifität eines Enzyms wird häufig das sogenannte Schlüssel-Schloss-Modell zur Veranschaulichung verwendet, da das Substrat so einzigartig zum Enzym passt wie ein Schlüssel zu einem Schloss. Das Induced-Fit-Modell ist eine Weiterentwicklung dieses Prinzips und sagt aus, dass die Bindungstasche (aktives Zentrum) des Enzyms bei Annäherung des richtigen Substrats eine leichte Konformationsänderung durchläuft, um sich noch besser an das Substrat anschmiegen zu können.
Die Wirkungsweise von Enzymen
Wie bereits beschrieben sind Enzyme Biokatalysatoren. Sie können die Geschwindigkeit einer Reaktion durch ihre katalytische Aktivität entweder erhöhen oder verringern. Der Verlauf einer Enzymreaktion ist im folgenden Energiediagramm dargestellt.
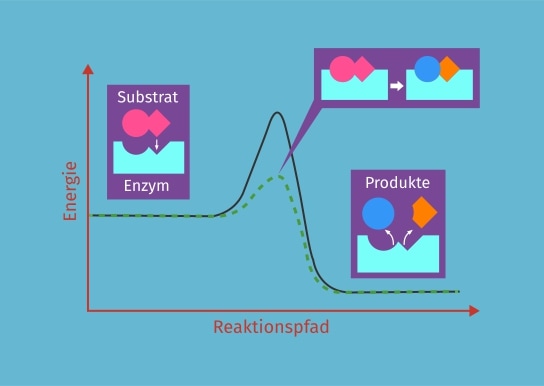
In diesem Fall erhöht das Enzym die Reaktionsgeschwindigkeit. Dies geschieht, indem das Enzym die Aktivierungsenergie der Reaktion herabsetzt. Die Aktivierungsenergie ist die Differenz der Energie der freien Edukte (Ausgangsstoffe) und der Energie des Übergangszustands. Die unkatalysierte Reaktion ist in der Abbildung als schwarzer Graph dargestellt. Der Übergangszustand ist energetisch ungünstig. Somit wäre eine große Menge an Energie nötig, damit die Reaktion abläuft. Durch ein Enzym kann der Übergangszustand energetisch günstiger werden (grün), wodurch weniger Energie notwendig ist und die Reaktion so schneller ablaufen kann.
Die Wirkungsspezifität von Enzymen
Wie oben beschrieben sind Enzyme substratspezifisch. Das heißt, es passen nur ganz bestimmte Substrate in ihr aktives Zentrum. Ein Enzym katalysiert jedoch nicht jede beliebige Reaktion, die sein Substrat eingehen könnte. In der Regel ist der Aufbau eines Enzyms genau auf die Katalyse bestimmter Reaktionen angepasst. Die Eigenschaft, dass Enzyme nur bestimmte Reaktionen ihres Substrats katalysieren, macht sie wirkungsspezifisch.
Die Hemmung enzymatischer Reaktionen
Die Enzymwirkung kann durch bestimmte Stoffe beeinflusst werden. Stoffe, die die Aktivität eines Enzyms herabsetzen, nennt man Inhibitoren. Eine ungehemmte Enzymreaktion ist prinzipiell immer schneller als eine gehemmte Enzymreaktion. Das liegt daran, dass durch den Inhibitor die katalytische Wirksamkeit des Enzyms herabgesetzt wird. Der Bau von Enzymen und ihre Funktionsweise ermöglichen drei verschiedene Arten der Hemmung: kompetitiv, unkompetitiv und nicht kompetitiv.
Kompetitiv bedeutet, dass der Inhibitor auch in der Bindungstasche des Enzyms binden kann und dadurch die Bindung des eigentlichen Substrats verhindert. Bei der nicht kompetitiven Hemmung bindet der Inhibitor an einer Stelle des Enzyms, die nicht die Bindungstasche ist (allosterisch). Dadurch durchläuft das Enzym eine Konformationsänderung, die die Bindung des Substrats im aktiven Zentrum verhindert. Die unkompetitive Hemmung betrifft den bereits gebildeten Enzym-Substrat-Komplex. Hier kann ein Inhibitor binden und dadurch die Umsetzung des Substrats zum Produkt verhindern.
Enzymreaktionen – Beispiele
In Lebewesen erfüllen Enzyme wichtige Funktionen. Sie sind an unzähligen biochemischen Prozessen beteiligt und ermöglichen so das Leben. Ein Beispiel für die Funktion von Enzymen beim Verdauungsprozess ist die Zersetzung von Stärke zu Glucose durch verschiedene Amylasen. Auch Proteine werden durch Enzyme in Aminosäuren gespalten. Solche Enzyme nennt man Proteasen.
Generell können Enzymreaktionen in sechs Klassen unterteilt werden. Die Klassen sind in der folgenden Tabelle mit je einem Enzym als Beispiel aufgeführt.
| Klasse | Reaktionstyp | Beispiele |
|---|---|---|
| 1. Oxidoreduktasen | Redoxreaktionen | Katalase |
| 2. Transferasen | Transfer von funktionellen Gruppen | Phosphofructokinase |
| 3. Hydrolasen | Hydrolysen | Trypsin |
| 4. Lyasen | Eliminierungsreaktionen | Fumarase |
| 5. Isomerasen | Isomerisierungen | Triosephosphat-Isomerase |
| 6. Ligasen | Bindungsknüpfung unter hydrolytischer Spaltung von ATP | Pyruvatcarboxylase |
Häufig gestellte Fragen zu Enzymreaktionen

