Metalle – Definition, Aufbau und Verwendung
Erfahre alles über Metalle: Sie nehmen 80% des Periodensystems ein und zeigen Eigenschaften wie Verformbarkeit und guten Glanz. Entdecke die Metallbindung, Sauerstoffaffinität und vielfältige Verwendungsmöglichkeiten wie in Elektrotechnik, Bau oder Schmuckherstellung. Tauche tiefer in die Welt der Metalle ein!
Inhaltsverzeichnis zum Thema Metalle
Wie willst du heute lernen?
Die Metalle im PSE
Die Metalle nehmen im Periodensystem der Elemente etwa 80 Prozent des Platzes ein. Bekannte Vertreter der Metalle sind Eisen, Aluminium oder Kupfer. Die verschiedenen Metalle können in Gruppen eingeordnet werden. Man kann beispielsweise aufgrund der Dichte der Metalle eine Einteilung in Leichtmetalle und Schwermetalle vornehmen.
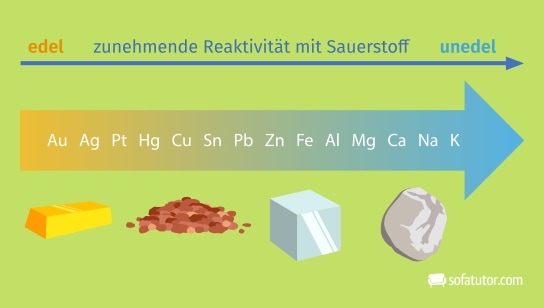
Eine weitere Gruppierung der Metalle im Periodensystem ist die Unterscheidung zwischen unedlen und edlen Metallen.
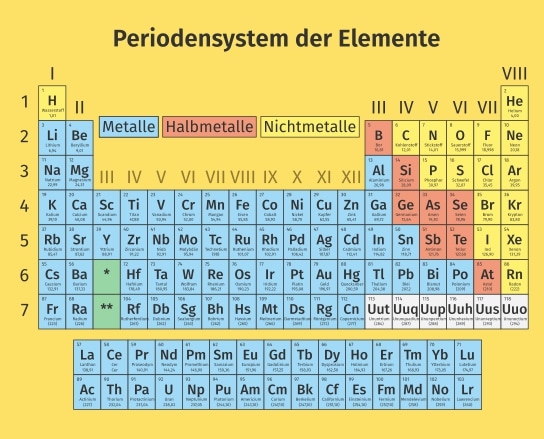
Einige chemische Elemente entlang der Grenze zwischen Metallen und Nichtmetallen gehören zu den sogenannten Halbmetallen. Sie zeigen nur unter bestimmten Bedingungen metallische Eigenschaften.
Eine Legierung ist ein homogener, metallischer Werkstoff aus mindestens zwei Elementen, von denen mindestens eines ein Metall ist. Bekannte Legierungen sind unter anderem Messing oder Stahl.
Eigenschaften der Metalle
Die folgenden vier Eigenschaften charakterisieren die Metalle:
- Metalle weisen einen typischen Glanz auf.
- Alle Metalle besitzen eine gewisse Verformbarkeit. Kupferdraht kann man zum Beispiel leicht verbiegen, robuste Metallstücke können geschmiedet werden.
- Metalle besitzen eine gute Wärmeleitfähigkeit.
- Eine gute elektrische Leitfähigkeit zeichnet alle Metalle aus.
Diese besonderen Eigenschaften verdanken die Metalle der sogenannten Metallbindung.
Metallbindung – Definition und Erklärung
Schauen wir uns dazu den Aufbau der Metalle und deren Atome an. Die Elektronen bewegen sich auf Schalen um die Atomkerne herum. Auf der äußersten Schale befinden sich dabei die Valenzelektronen, die für die chemische Bindung verantwortlich sind.
Im Metall bilden dabei ganz viele positive Metallionen (Atomrümpfe) ein Metallgitter aus eng benachbarten Atomrümpfen. Die Valenzelektronen bewegen sich dabei frei zwischen allen Metallatomen im Gitter und ermöglichen so die Bindung der Metallatome untereinander. Die Valenzelektronen sind im Metall nicht mehr lokal an einen Ort gebunden, sondern sie sind über das gesamte Metallgitter delokalisiert, ähnlich wie Gasteilchen in der Luft. Man spricht aus diesem Grund hier auch von Elektronengas. Diese Art der Bindung nennt man in der Chemie Metallbindung.
Auf dem folgenden Bild ist als Beispiel das Modell der Metallbindung dargestellt.

Sauerstoffaffinität der Metalle
Metalle weisen eine unterschiedliche Affinität zu Sauerstoff auf. Dabei reagieren unedle Metalle besser mit Sauerstoff als edle Metalle, wodurch sich eine Affinitätsreihe ableiten lässt. Edle Metalle, Beispiele sind hier Gold oder Silber, reagieren kaum mit Sauerstoff. Unedle Metalle, wie beispielsweise Kalium und Natrium, reagieren sehr stark mit Sauerstoff. Die allgemeine Reaktion lautet hier:
Metall + Sauerstoff → Metalloxid
Verwendung von Metallen
Die Verwendungsmöglichkeiten der Metalle sind sehr vielfältig. In der folgenden Liste sind Metalle und einige ihrer Einsatzgebiete aufgeführt.
| Beispiele für Metalle | Verwendung |
|---|---|
| Eisen | Hauptbestandteil von Stahl, Bautechnik |
| Kupfer | Elektrotechnik, Münzen, Musikinstrumente, Bauindustrie |
| Gold | Schmuckindustrie |
| Natrium | Bestandteil von Speisesalz, Arznei- und Waschmitteln |
| Lithium | Bestandteil von Batterien und Akkus |
Häufig gestellte Fragen zum Thema Metalle









Alle Artikel aus dem Fach Chemie