Salpetersäure – Verwendung, Herstellung und Vorkommen
Erfahre, dass Salpetersäure eine starke, anorganische Säure ist, die bei der Herstellung von Düngemitteln, Farbstoffen und als Königswasser in der Metallurgie verwendet wird. Entdecke auch, wie sie hergestellt wird und welche Gefahren sie birgt. Dies und vieles mehr findest du im folgenden Text!
Inhaltsverzeichnis zum Thema Salpetersäure
Wie willst du heute lernen?
Salpetersäure – Steckbrief
In der folgenden Tabelle sind die wichtigsten chemisch-physikalischen Eigenschaften von Salpetersäure zusammengefasst. Die hier dargestellten Werte beziehen sich auf konzentrierte Salpetersäure (100 %). Die Werte für verdünnte Salpetersäure können abweichen. Hundertprozentige Salpetersäure zersetzt sich leicht an der Luft. Dabei entsteht freies Stickstoffdioxid (NO2), das als gelber bis roter Rauch aufsteigt. Daher der Name rauchende Salpetersäure.
| Eigenschaft | Wert |
|---|---|
| Aggregatzustand | flüssig |
| Formel/Summenformel | HNO3 |
| Geruch | stechend |
| Dichte | 1,513 g/cm3 |
| pH-Wert | < 1 |
| pKs-Wert | –1,377 |
| Schmelzpunkt | -41,6 °C |
| Siedepunkt | 83 °C |
Salpetersäure sieht als Strukturformel bzw. Lewis-Formel dargestellt wie folgt aus:
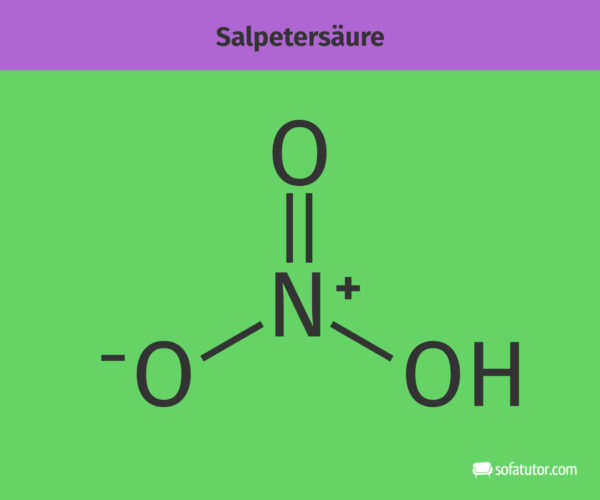
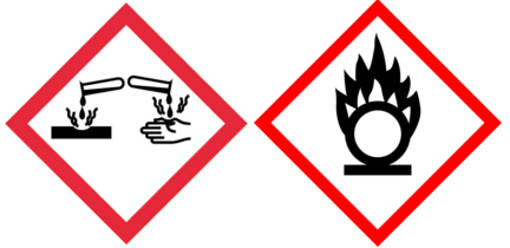
Von Salpetersäure gehen einige Gefahren aus. Salpetersäure kann die Haut verätzen und wirkt reizend auf die Atemwege. Außerdem ist es brandfördernd und wirkt stark oxidierend. Das sind die Gefahrensymbole für Salpetersäure:
Salpetersäure – Reaktionsgleichungen
Als Säure gibt Salpetersäure Protonen (H+) ab, die mit Wasser (H2O) zu Oxoniumionen (H3O+) reagieren. Übrig bleiben Nitrationen (NO3–). Salpetersäure dissoziiert also in Wasser zu Oxoniumionen und Nitrationen. Die Dissoziationsgleichung bzw. Reaktionsgleichung von Salpetersäure in Wasser lautet:
HNO3 + H2O → NO3– + H3O+
Salpetersäure – Neutralisationsreaktion
Salpetersäure kann neutralisiert werden, indem sie mit Laugen reagiert. Salpetersäure reagiert etwa mit Natronlauge (Natriumhydroxid, (NaOH) unter der Bildung von Natriumnitrat (NaNO3) und Wasser:
NaOH + HNO3 → NaNO3 + H2O
Salpetersäure – Reaktion mit Metallen
Mit Metallen reagiert Salpetersäure unter der Bildung von Salzen, Nitrate genannt. Die meisten Metalle lösen sich dabei vollständig auf. Als Beispiel soll hier die Reaktion von Zink (Zn) mit Salpetersäure zu Zinknitrat Zn(NO3)2 gezeigt werden. Als weiteres Produkt entweicht bei dieser Reaktion gasförmiges Stickstoffmonoxid (HNO):
3 Zn + 8 HNO3 → 3 Zn(NO3)2 + 4 H2O + 2 NO
Scheidewasser oder Königswasser
Die Mischung aus Salpetersäure und Salzsäure wird als Königswasser bezeichnet. Diese Lösung kann Silber auflösen, Gold jedoch nicht. Deshalb kann Königswasser zur Trennung von Silber und Gold verwendet werden, daher ist auch der Name Scheidewasser gebräuchlich.
Salpetersäure – Herstellung
Im Labor wird Salpetersäure durch Reaktion von Kaliumnitrat (KNO3) mit Schwefelsäure (H2SO4) gewonnen. Neben Salpetersäure entsteht zusätzlich Kaliumhydrogensulfat (KHSO4):
KNO3 + H2SO4 → HNO3 + KHSO4
In der Industrie wird das Ostwaldverfahren eingesetzt, um Salpetersäure herzustellen:
- Im ersten Schritt wird Ammoniak (NH3) zu Stickstoffmonoxid (NO) oxidiert:
4 NH3 + 5 O2 → 4 NO + 6 H2O - Im zweiten Schritt wird Stickstoffmonoxid weiter oxidiert zur Stickstoffdioxid (NO2):
2 NO + O2 → 2 NO2 - Im dritten Schritt reagiert Stickstoffdioxid mit Wasser zu Salpetersäure nach folgender Reaktionsgleichung:
3 NO2 + H2O → 2 HNO3 + NO
Salpetersäure – Verwendung
Salpetersäure ist eine wichtige Substanz und findet vielfältige Verwendungsmöglichkeiten:
- als Düngemittel in Form von Nitraten,
- als Silbernitrat in der Fotoindustrie,
- als Königswasser in der Metallurgie und
- als Ausgangsstoff zur Nitrierung bei der Herstellung von Farbstoffen und Sprengstoffen.
Häufig gestellte Fragen zum Thema Salpetersäure









Alle Artikel aus dem Fach Chemie