Radikalische Substitution – Chemie, Beispiele und Mechanismus
Erfahre, wie Radikale in der organischen Chemie Atomgruppen ersetzen und warum sie hochreaktiv sind. Finde heraus, wie die drei Schritte – Startreaktion, Kettenreaktion und Kettenabbruch – ablaufen. Dies und vieles mehr findest du im folgenden Text.
Inhaltsverzeichnis zum Thema Radikalische Substitution
Wie willst du heute lernen?
Radikalische Substitution – Definition
Die radikalische Substitution ist einer von vielen Reaktionsmechanismen in der organischen Chemie
Reaktionsmechanismus der radikalischen Substitution
Die radikalische Substitution läuft in drei Schritten ab:
- Startreaktion
- Kettenreaktion
- Kettenabbruch
Eine häufig gezeigte Musterreaktion für die radikalische Substitution ist die Halogenierung von Alkanen mit elementaren Halogenen. Für den Ablauf einer Halogenierung ist im Folgenden die radikalische Substitutionsreaktion als Beispiel mit Chlor gezeigt.
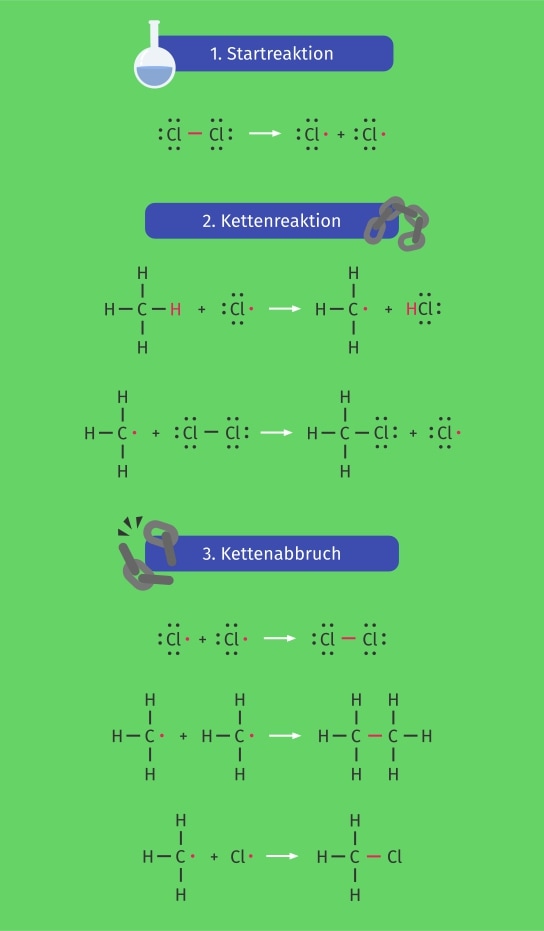
Zu Beginn jeder Radikalreaktion müssen zunächst Radikale generiert werden. Dieser Schritt wird als Startreaktion bezeichnet. Im Fall von Chlor entstehen die Radikale durch die Fotolyse von Chlor. Dabei wird die Einfachbindung von elementarem Chlor durch die Einwirkung von Licht gespalten. Die Spaltung der Bindung erfolgt für die Radikalbildung homolytisch. Die beiden Bindungselektronen werden also auf beide Chloratome aufgeteilt. Somit entstehen bei der Homolyse zwei gleichwertige Chlorradikale, die jeweils ein ungepaartes Elektron besitzen. Für die radikalische Substitution ist die homolytische Spaltung essenziell, da bei einer heterolytischen Spaltung keine Radikale entstehen würden.
Im nächsten Schritt, der Radikalkettenreaktion, greift nun eines der Chlorradikale das Alkan an und entfernt ein Wasserstoffatom homolytisch. Es bleibt also ein freies Elektron am Alkylrest zurück. Außerdem entsteht Chlorwasserstoff als Nebenprodukt. Das entstandene Alkylradikal kann jetzt wieder elementares Chlor angreifen. Dabei bildet sich eine kovalente Bindung zwischen dem Alkylrest und einem Chloratom und es bleibt ein Chlorradikal zurück. Mit diesem Chlorradikal kann die Kettenreaktion wieder von vorne starten. Pro gespaltenem Chlormolekül kann die Kettenreaktion ca. 106-mal ablaufen, bis es zum Kettenabbruch kommt. Im Produkt wurde nun ein Wasserstoffatom durch ein Chloratom ersetzt (Substitution am Alkan).
Das Ende der Kettenreaktion wird durch den Kettenabbruch verursacht. Dabei treffen zwei Radikale aufeinander, wobei kein neues Radikal mehr entsteht. Für den Kettenabbruch gibt es drei Kombinationsmöglichkeiten für die vorhandenen Radikale. Reagieren zwei Chlorradikale miteinander, entsteht elementares Chlor. Es können aber auch zwei Alkylradikale miteinander reagieren und so ein Alkan mit doppelter Kettenlänge bilden. Als dritte Kombinationsmöglichkeit kann ein Alkylradikal mit einem Chlorradikal reagieren, wodurch das gleiche Produkt wie das aus der Kettenreaktion gebildet wird.
Die Selektivität der radikalischen Substitution
Beim gezeigten Beispiel sind alle Wasserstoffatome des Alkans äquivalent. Das heißt, egal welches Wasserstoffatom substituiert wird, das Produkt ist immer gleich. Sieht man sich nun die radikalische Substitutionsreaktion am Propan an, ändert sich dies. Hier sind nun nicht mehr alle Wasserstoffatome äquivalent. Im Propan sind insgesamt sechs Wasserstoffatome an einen primären Kohlenstoff gebunden und zwei an einen sekundären. Nach der Substitution steht das Chloratom also entweder an einem der endständigen, primären Kohlenstoffatome (1-Chlorpropan) oder am mittleren, sekundären Kohlenstoff (2-Chlorpropan). Für die Verteilung der beiden möglichen Produkte könnte man annehmen, dass von 1-Chlorpropan mehr gebildet wird, da hier mehr Wasserstoffatome zur Auswahl stehen. Dies ist allerdings nicht der Fall. 2-Chlorpropan entsteht zu einem leicht erhöhten Anteil, da die C-H-Bindungen am sekundären Kohlenstoff schwächer sind als die am primären Kohlenstoff. Hinzu kommt noch die wichtige Tatsache, dass ein Radikal am sekundären Kohlenstoffatom deutlich stabiler ist als am primären.
Die beiden Faktoren für die Selektivität werden bei der radikalischen Substitution mit Brom noch deutlicher erkennbar. Brom reagiert deutlich langsamer und dadurch selektiver als Chlor. Deshalb haben die Effekte der Bindungsstärke und der Radikalstabilität einen größeren Einfluss auf den Verlauf der Reaktion. Das Verhältnis der Substitutionsprodukte der Monobromierung wird so noch größer und 2-Brompropan wird so zu einem viel größeren Anteil gebildet als 1-Brompropan. Die Reaktivität und damit Selektivität spielt in der Chemie eine große Rolle, da es von Vorteil ist, möglichst kleine Anteile des Nebenprodukts zu bilden.
Beispiele für die radikalische Substitution
Für die radikalische Substitution gibt es viele verschiedene Beispiele. Bei der radikalischen Substitution mit Brom an Hexan entsteht Bromhexan. Bei der Bromierung von Ethan und Heptan entstehen Bromethan und Bromheptan. Je nach Länge der Alkylketten können unterschiedlich viele Isomere mit verschieden großer Wahrscheinlichkeit entstehen.
| Reagenz | Reaktion | Produkt |
|---|---|---|
| Cl2, Br2 (heftige Reaktion für Cl2) | Halogenierung | R-Cl, R-Br |
| Sulfurylchlorid (sanfter) | Chlorierung | R-Cl |
| NBS (für allylische Positionen) | Bromierung | R-CH=CH-CH2-Br |
| Sauerstoff (O2) | Peroxygenierung | R-O-O-H |
| SO2, Cl2 | Sulfochlorierung | R-SO2Cl |
Radikalische Substitution – besondere Reaktionsbedingungen
Eine bekannte Namensreaktion, die nach dem Mechanismus einer radikalischen Substitution verläuft, ist die Wohl-Ziegler-Reaktion oder genauer Wohl-Ziegler-Bromierung. Hierbei handelt es sich speziell um die Bromierung der allylischen Position eines Alkens. Als allylische Position wird das erste Kohlenstoffatom nach einer Doppelbindung bezeichnet. Unter normalen Bedingungen würde die Doppelbindung eines Alkens mit elementarem Brom in einer radikalischen Addition reagieren. Sind allerdings nur sehr geringe Mengen an Brom im Reaktionsgemisch vorhanden, findet diese Reaktion nicht statt. Stattdessen kann eine allylische Bromierung mit NBS durchgeführt werden. NBS steht für das Reagenz N-Brom-Succinimid, das im Reaktionsgemisch stetig kleinste Mengen an Brom liefert, die dann in einer radikalischen Substitution am allylischen Kohlenstoffatom reagieren.
Radikalische Substitution an Aromaten
Die radikalische Substitution an einem aromatischen Ring ist aufgrund der geringen Stabilität von Arylradikalen ungünstig. Sind allerdings Alkylketten an die Kohlenstoffatome des Aromaten gebunden, stellt das Kohlenstoffatom, das direkt an den Aromaten benachbart ist, eine sehr günstige Position für eine radikalische Substitution dar. Ein Beispiel hierfür ist Toluol, das eine Methylgruppe als Seitenkette am Benzolring trägt.
Die Konkurrenzreaktion zur radikalischen Substitution an der Seitenkette des Aromaten ist die elektrophile Substitution am Benzolring. Beide Reaktionen können zum Beispiel mit elementarem Brom ablaufen. Welche Reaktion stattfindet, hängt stark von den Reaktionsbedingungen ab. Zur Beurteilung dieser Situation gibt es die SSS- und KKK-Regel. Strahlung und Wärme begünstigen die Bildung von Radikalen. Somit fördern sie die radikalische Substitution an der Seitenkette des Aromaten. Ein Katalysator wie FeBr3 fördert die Entstehung des positiv geladenen Bromions und damit die elektrophile Substitution am Aromaten (Kern).
SSS: Strahlung/Sonne, Siedehitze, Seitenkette
KKK: Katalysator, Kälte, Kern
Häufig gestellte Fragen zum Thema Radikalische Substitution









Alle Artikel aus dem Fach Chemie