Die Elektronenpaarbindung – polare und unpolare Atombindungen
Tauche ein in die Welt der Elektronenpaarbindung, wo Atome sich Elektronen teilen, um stabile Verbindungen zu bilden. Lerne, wie polare und unpolare Atombindungen entstehen, welchen Einfluss Elektronegativität hat und warum dies für die Chemie von Bedeutung ist. Interessiert? Dies und vieles mehr findest du im folgenden Text!
Inhaltsverzeichnis zum Thema Elektronenpaarbindung, Atombindung
Das Quiz zum Thema: Elektronenpaarbindung, Atombindung
Was definiert eine Elektronenpaarbindung?
Frage 1 von 5
Wann liegt eine unpolare Atombindung vor?
Frage 2 von 5
Was ist die Elektronegativitätsdifferenz für polare Atombindungen?
Frage 3 von 5
Welche Bindung entsteht bei einer Elektronegativitätsdifferenz größer als 1,8?
Frage 4 von 5
Was ermöglicht die Ausbildung von Wasserstoffbrückenbindungen?
Frage 5 von 5
Wie willst du heute lernen?
Elektronenpaarbindung – Definition
Es gibt mehrere verschiedene Bindungstypen in der Chemie. Sie lassen sich unterteilen in starke und schwache Bindungen. Zu den starken Bindungen gehören die Elektronenpaarbindung, die Ionenbindung und die Metallbindung. Die Elektronenpaarbindung wird auch Atombindung, kovalente Bindung oder homöopolare Bindung genannt und bezeichnet den Bindungstyp, bei dem sich zwei Atome ein Elektronenpaar teilen und so aneinander gebunden sind. Ein Bindungspartner steuert dabei immer jeweils ein Elektron seiner Valenzelektronen bei. Durch das Teilen der Valenzelektronen streben beide Atome an, die Edelgaskonfiguration zu erreichen. Das geteilte Elektronenpaar wird in der Lewisformel als verbindender Strich zwischen den Atomen geschrieben. Als Beispiel für die Schreibweise von kovalenten Bindungen ist in der folgenden Abbildung das Chlormolekül gezeigt.

Polare und unpolare Elektronenpaarbindungen
Kovalente Bindungen können je nach Elektronegativitätswert der Bindungspartner in polare und unpolare Atombindungen unterschieden werden. Die Eigenschaften einer Atombindung werden also maßgeblich durch die Elektronegativität beeinflusst.
Beispiele für unpolare Atombindungen
Einige Elemente liegen in reiner Form nur molekular vor, also als Moleküle, in denen die Atome des Elements durch kovalente Bindungen verbunden sind. Beispiele für solche Elemente sind Wasserstoff (H2), die Halogene (F2, Cl2, Br2, I2) und Sauerstoff (O2). Eine Gemeinsamkeit der kovalenten Bindungen dieser Moleküle ist, dass es sich dabei um unpolare Atombindungen handelt. Unpolar bedeutet hier, dass die Elektronen der kovalenten Bindung symmetrisch auf beiden Seiten der Bindung verteilt sind. Dies ist dadurch möglich, dass die Differenz der Elektronegativität der beiden Bindungspartner nicht größer als 0,5 ist. Da bei den genannten Beispielen beide Bindungspartner identisch sind, haben sie auch die gleiche Elektronegativität und die Differenz liegt bei null. Die Elektronegativität ist entscheidend für die Elektronenverteilung zwischen den Bindungspartnern, da sie definiert, wie stark ein Bindungspartner die Elektronen zu sich zieht. Haben beide Bindungspartner die gleiche Elektronegativität, ziehen sie die Elektronen gleich stark zu sich und es entsteht eine gleichmäßige, symmetrische Verteilung.
Unpolare Moleküle müssen aber nicht zwingend zwei gleiche Atome als Bindungspartner haben. Kohlenstoff und Wasserstoff haben beispielsweise eine Elektronegativitätsdifferenz von 0,4. Sie erfüllen also noch nicht das Kriterium für eine polare Bindung. Damit lässt sich die unpolare Natur der Kohlenwasserstoffe erklären.
Beispiele für polare Atombindungen
Eine polare kovalente Bindung liegt vor, wenn die Elektronegativitätsdifferenz der Bindungspartner bei 0,6 bis 1,8 liegt. Dies bedeutet, dass ein Bindungspartner so viel elektronegativer als der andere ist, dass er die Elektronenverteilung zu sich hin verzerrt. Es befindet sich somit mehr Elektronendichte beim elektronegativeren Bindungspartner. Damit ist die Seite der Bindung, auf der das elektronegativere Atom sitzt, negativ polarisiert und die andere Seite entsprechend positiv polarisiert.
Je nach Aufbau des Moleküls können polarisierte Atombindungen auch dazu führen, dass das gesamte Molekül polarisiert ist. Man bezeichnet dies dann als Dipol. Ein anschauliches Beispiel hierfür ist die Atombindung im Wasser. Im Wassermolekül sind am elektronegativen Sauerstoff zwei Wasserstoffatome durch kovalente Bindungen gebunden. Der elektronegative Sauerstoff polarisiert beide Bindungen so, dass die Elektronendichte zu ihm verschoben ist. Er ist dadurch negativ polarisiert. Durch die gewinkelte Form des Wassermoleküls sitzt der negativ polarisierte Sauerstoff auf der gegenüberliegenden Seite der positiv polarisierten Wasserstoffatome. Damit ist das gesamte Molekül polarisiert.
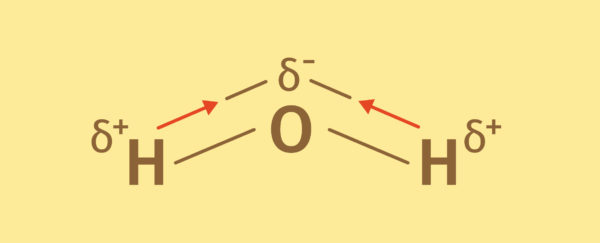
Eigenschaften von polaren Atombindungen
Polare Atombindungen spielen in der Chemie eine wichtige Rolle. Sie sind wichtig für Dissoziationsprozesse und Protonierungen bei Säure-Base-Reaktionen. Sie sind außerdem der Grundbaustein für die Ausbildung von Wasserstoffbrückenbindungen, die für die Biochemie des Lebens unabkömmlich sind.
Der Unterschied zwischen Ionenbindungen und Atombindungen
Ob eine Atombindung polar oder unpolar ist, entscheidet die Elektronegativität der Bindungspartner. Mithilfe der Elektronegativität kann aber auch zwischen Bindungsarten unterschieden werden. Damit ist die Elektronegativität für die Chemie von zentraler Bedeutung. In der folgenden Tabelle ist die Einteilung der Bindungstypen nach der Elektronegativitätsdifferenz der Bindungspartner gezeigt.
| Bindungstyp | Elektronegativitätsdifferenz |
|---|---|
| Atombindung, unpolar | < 0,5 |
| Atombindung, polar | 0,6–1,8 |
| Ionenbindung | > 1,8 |
Ab einer Elektronegativitätsdifferenz von 1,8 liegt eine Ionenbindung vor. Hierbei ist ein Atom bereits so viel elektronegativer, dass es seinem Bindungspartner die Elektronen vollständig entzieht und nicht mehr nur eine Bindung polarisiert. Eine Ausnahme bildet hier das Molekül des Fluorwasserstoffs. Hier liegt zwar eine Elektronegativitätsdifferenz von 1,9 vor, es handelt sich aber um eine reine Atombindung und keine Ionenbindung.
Häufig gestellte Fragen zum Thema Elektronenpaarbindung








Alle Artikel aus dem Fach Chemie