Van-der-Waals-Kräfte einfach erklärt – Chemie, Definition und Beispiele
Erfahre, wie schwache Wechselwirkungen zwischen Atomen und Molekülen wirken. Diese Kräfte spielen eine entscheidende Rolle in der Chemie, wirken auf kurze Distanz und resultieren aus unterschiedlichen Ladungsverteilungen.
Inhaltsverzeichnis zum Thema Van-der-Waals-Kräfte
Das Quiz zum Thema: Van-der-Waals-Kräfte
Was sind Van-der-Waals-Kräfte?
Frage 1 von 5
Wie entsteht eine Dipol-Dipol-Wechselwirkung?
Frage 2 von 5
Welche Rolle spielt die Elektronegativität bei Van-der-Waals-Kräften?
Frage 3 von 5
Was ist ein temporärer Dipol bei den Van-der-Waals-Kräften?
Frage 4 von 5
Welche Art von Molekülen sind meistens von Van-der-Waals-Kräften betroffen?
Frage 5 von 5
Wie willst du heute lernen?
Van-der-Waals-Kräfte – Definition
Van-der-Waals-Kräfte sind Wechselwirkungen zwischen Atomen und Molekülen. Sie gehören zu den sogenannten zwischen- oder intermolekularen Kräften. Van-der-Waals-Kräfte bewirken einen wesentlich schwächeren Zusammenhalt als chemische Bindungen und wirken nur auf eine sehr kurze, räumliche Distanz.
Van-der-Waals-Wechselwirkungen beruhen immer auf unterschiedlicher Ladungsverteilung in den Stoffen. Im Folgenden wird die Entstehung der Van-der-Waals-Kräfte in drei verschiedenen Fällen näher erläutert:
Van-der-Waals-Kräfte – Dipol-Dipol-Wechselwirkung
Die Elektronen in einem Molekül oder Atom sind ständig in Bewegung. Das führt zu einer unsymmetrischen Ladungsverteilung. Sind in einem Molekül die Elektronegativitätsdifferenzen zwischen zwei Bindungspartnern groß, trägt das Atom mit der geringeren Elektronegativität eine positive Partialladung, das Atom mit der höheren Elektronegativität eine negative Partialladung. Das Molekül ist polar, es bildet einen Dipol.
Zwischen den unterschiedlichen Partialladungen treten elektrostatische Wechselwirkungen auf. Das führt zu einem schwachen Zusammenhalt zwischen den Molekülen. Diese Ausprägung der Van-der-Waals-Kraft ist in der organischen Chemie z. B. bei Ketonen zu erkennen. In dieser Stoffklasse bildet die Doppelbindung zwischen Kohlenstoff und Sauerstoff (C=O) einen Teil der funktionellen Gruppe. Aufgrund der höheren Elektronegativität sind die Elektronenpaare der Doppelbindung zum Sauerstoff hin verschoben, der somit negativ polarisiert ist. Der Kohlenstoff trägt dann eine positive Partialladung. Die positive Ladung des einen Ketons wechselwirkt mit der negativen Ladung des anderen Ketons. So entsteht ein schwacher Zusammenhalt zwischen den verschiedenen Molekülen.
Van-der-Waals-Kräfte – Wechselwirkung zwischen einem Dipol und einem induzierten Dipol
Die eben beschriebenen permanenten Dipole können in unpolaren Molekülen einen Dipol induzieren. Diese bilden dann einen temporären Dipol aus und wechselwirken mit dem permanenten Dipolmolekül. Ein temporärer Dipol kann leicht in Molekülen induziert werden, die über ?-Elektronen in der Bindung verfügen, da diese leicht verschiebbar sind. Nähert sich der negative Teil des Dipols den ?-Elektronen des unpolaren Moleküls, werden diese abgestoßen und die Ladungsverteilung verschiebt sich. Das ist zum Beispiel bei aromatischen Verbindungen wie dem Benzol der Fall. Das Benzol kann durch permanente Dipole, wie beispielsweise dem Wassermolekül, temporär polarisiert werden.
Van-der-Waals-Kräfte – Wechselwirkung zwischen zwei induzierten Dipolen
Wenn von Van-der-Waals-Kräften die Rede ist, werden meistens die zwischenmolekularen Wechselwirkungen zwischen zwei unpolaren Molekülen gemeint. Die Elektronen in einem Molekül oder Atom sind ständig in Bewegung. Das führt zu einer unsymmetrischen Ladungsverteilung, durch die auch in einem unpolaren Molekül ein spontaner Dipol ausgelöst werden kann. Dieser Dipol kann, wie im vorigen Abschnitt beschrieben, in einem anderen, unpolaren Molekül einen Dipol induzieren. Beruht die Van-der-Waals Kraft auf dieser Wechselwirkung, ist auch von londonschen Dispersionskräften die Rede. Beispiele für Stoffe, bei denen die zwischenmolekularen Van-der-Waals-Kräfte auf diese Weise entstehen, sind die Alkane. Je größer die Kettenlänge der Alkane, desto stärker sind die wirkenden Van-der-Waals-Kräfte. Das führt auch dazu, dass langkettige Alkane eine höhere Siedetemperatur haben als kurzkettige Alkane. Die Van-der-Waals-Kräfte sorgen dafür, dass der Zusammenhalt bei langkettigen Alkanen stärker ist und diese nicht so leicht in die Gasphase übergehen können.
Auch der Gecko macht sich die Van-der-Waals Kräfte zunutze, um auf senkrechten Flächen klettern zu können. Die Unterseite der Füße des Geckos sind mit feinen Härchen besetzt. Zwischen der Oberfläche und den Härchen wirken die Van-der-Waals Kräfte. Die Wechselwirkung wird mit steigender Anzahl der Härchen immer stärker.
Van-der-Waals-Kräfte und Wasserstoffbrückenbindung
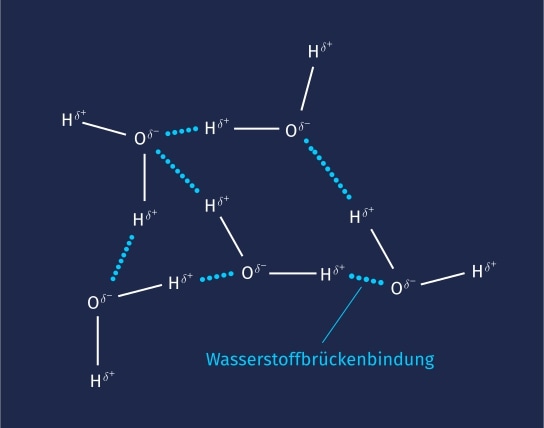
Eine weitere zwischenmolekulare Wechselwirkung, die von der Van-der-Waals-Kraft zu unterscheiden ist, ist die Wasserstoffbrückenbindung. Im Unterschied zu der Van-der-Waals-Kraft werden Wasserstoffbrückenbindungen nur zwischen polaren Molekülen ausgebildet, z. B. im Wasser. Dabei wechselwirkt das Wasserstoffatom des einen Moleküls mit einem freien Elektronenpaar eines anderen Moleküls. Wasserstoffbrückenbindungen sind wesentlich stärker als Van-der-Waals-Kräfte.
| Zwischenmolekulare Kräfte | Beschreibung | Beispiel |
|---|---|---|
| Van-der-Waals-Kräfte | Van-der-Waals-Kräfte beschreiben schwache elektrostatische Wechselwirkungen zwischen Molekülen. | Diese Wechselwirkung kann man zwischen Methanmolekülen (unpolar) beobachten. |
| Wasserstoffbrückenbindungen | Wasserstoffbrücken beschreiben die stärkste elektrostatische Wechselwirkung zwischen Molekülen. | Diese Wechselwirkung kann man zwischen Wassermolekülen (polar) beobachten. |
Häufig gestellte Fragen zum Thema Van-der-Waals-Kräfte









Alle Artikel aus dem Fach Chemie