Ester – Chemie, Reaktionen und Beispiele
Lerne, wie Ester durch die Reaktion von Alkoholen mit Carbonsäuren entstehen und welche vielfältigen Eigenschaften sie haben. Von der Nomenklatur bis zur Anwendung in Alltagsprodukten – Ester spielen eine wichtige Rolle! Interessiert? Dies und vieles mehr findest du im folgenden Text.
Inhaltsverzeichnis zum Thema Ester
Das Quiz zum Thema: Ester
Wie entsteht ein Ester?
Frage 1 von 5
Was passiert bei der Synthese eines Esters?
Frage 2 von 5
Welche Eigenschaften haben kurz- und langkettige Ester?
Frage 3 von 5
Wozu dienen Ester im Alltag häufig?
Frage 4 von 5
Welcher Unterschied besteht zwischen Estern und Ethern?
Frage 5 von 5
Wie willst du heute lernen?
Ester – Definition
Durch die Kondensation eines Alkohols mit einer Carbonsäure entsteht eine neue funktionelle Gruppe, die Esterbindung. Das entstandene Molekül wird Ester oder Carbonsäureester genannt. Wenn anorganische Sauerstoffsäuren mit einem Alkohol reagieren, können sich ebenfalls Ester bilden, die aber keine Carbonsäureester sind. Ein Beispiel hierfür sind Phosphorsäureester.
Carbonsäureester sind alle nach dem gleichen Prinzip aufgebaut. Durch die Kondensationsreaktion wird die OH-Gruppe der Carbonsäure durch den deprotonierten Alkohol ersetzt. In der folgenden Abbildung ist die allgemeine Strukturformel für Ester und Propansäuremethylester als Beispiel für einen Ester abgebildet.
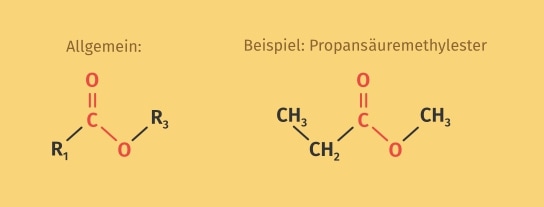
Ester – Bildung
Zur Synthese von Estern werden Alkohole und Carbonsäuren benötigt. Diese beiden Stoffe reagieren in einer Kondensationsreaktion zu einem Ester. Für eine erfolgreiche Reaktion zum Ester wird der Reaktionsmischung noch eine starke anorganische Säure als Katalysator zugefügt. Dies kann zum Beispiel eine geringe Menge an Schwefelsäure sein.
Bei der Synthese von Estern können verschiedene Carbonsäuren und Alkohole beliebig kombiniert werden. Dabei kann dann eine große Vielfalt verschiedener Ester entstehen.
Durch eine basische Hydrolyse können Ester wieder zu Carbonsäuren und Alkoholen gespalten werden. Dies ist also die Umkehrreaktion zur Esterbildung.
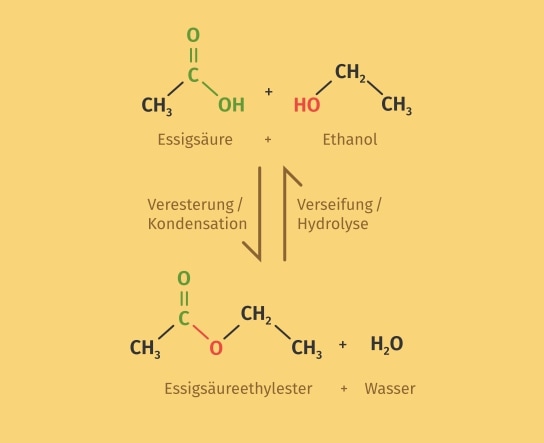
Eigenschaften von Estern
Die Eigenschaften von Estern können sich je nach ihrer Struktur unterscheiden. Ester mit kürzeren Alkylketten sind durch die polare Estergruppe gut in hydrophilen Lösungsmitteln löslich. Je länger jedoch die Alkylketten der Ester werden, desto schlechter löslich sind sie in hydrophilen Lösungsmitteln, da die unpolare Natur der Alkylketten dann überwiegt. Ein Beispiel für solche langkettigen Ester sind Fettsäureester, die nicht wasserlöslich sind.
Ester – Nomenklatur
Zur Nomenklatur von Estern ist die Länge der Kohlenstoffkette an der Carbonsäure und am Alkohol ausschlaggebend. So heißt zum Beispiel der Ester, der durch die Kondensation von Essigsäure (Ethansäure) und Ethanol entsteht, Ethansäureethylester oder auch Essigsäureethylester. Umgangssprachlich wird Essigsäureethylester auch einfach nur als Ethylester bezeichnet. Diese Bezeichnung ist allerdings nicht genau. Allgemein gesagt können Ester, die aus einer Carbonsäure und Methanol entstehen, als Methylester bezeichnet werden und Ester, die aus einer Carbonsäure und Ethanol entstanden sind, als Ethylester. Weitere Beispiele für verschiedene Kombinationen sind in der folgenden Tabelle aufgeführt.
Bei der Nomenklatur werden Carbonsäureester ähnlich wie die Salze der entsprechenden Carbonsäure benannt. Salze oder Ester der Essigsäure werden zum Beispiel jeweils mit der Nachsilbe -acetat bezeichnet.
Sind an einer Alkylkette zwei Estergruppen, nennt man eine solche Verbindung Diester.
| Edukte | Bezeichnungen | |||
|---|---|---|---|---|
| Ameisensäure (Methansäure) und Methanol | Methansäuremethylester, Ameisensäuremethylester, Methylmethanoat, Methylformiat |
|||
| Ameisensäure (Methansäure) und Ethanol | Methansäureethylester, Ameisensäureethylester, Ethylmethanoat, Ethylformiat |
|||
| Ameisensäure (Methansäure) und Propanol | Methansäurepropylester, Ameisensäurepropylester, Propylmethanoat, Propylformiat |
|||
| Essigsäure (Ethansäure) und Methanol | Ethansäuremethylester, Essigsäuremethylester, Methylethanoat, Methylacetat |
|||
| Essigsäure (Ethansäure) und Ethanol | Ethansäureethylester, Essigsäureethylester, Ethylethanoat, Ethylacetat |
|||
| Essigsäure (Ethansäure) und Propanol | Ethansäurepropylester, Essigsäurepropylester, Propylethanoat, Propylacetat |
Ester – Verwendung
Viele verschiedene Ester finden im Alltag Verwendung. Essigsäureethylester wird zum Beispiel sehr häufig als Lösungsmittel verwendet und ist auch als Nagellackentferner weitverbreitet. Einige Ester, wie zum Beispiel Butansäureethylester aus der Ananas, kommen in Früchten vor und werden deshalb auch Fruchtester genannt. Die Verwendung dieser Ester als Geruchs- und Geschmacksstoffe ist weitverbreitet. Auch anhand der Strukturformeln von Biodiesel (Gemisch aus Fettsäuremethylester) lässt sich leicht erkennen, dass dieser aus langkettigen Estern zusammengesetzt ist. Die Bedeutung von Estern ist sehr vielseitig und sie sind weitreichend im Alltag vertreten.
Reaktionen von Estern
Eine wichtige Reaktion, an der Ester beteiligt sind, ist die Claisen-Kondensation. Hier reagieren zwei Ester basenkatalysiert miteinander zu einem β-Ketoester. Neben der Claisen-Reaktion werden Ester aber auch anderweitig vielseitig in der organischen Synthese eingesetzt.
Ester vs. Ether
Der entscheidende Unterschied zwischen Estern und Ethern ist das doppelt gebundene Sauerstoffatom in Nachbarschaft zum Sauerstoffatom, das die zusätzliche Alkylgruppe im Ester trägt R1-(C=O)-OR2. Die funktionelle Gruppe im Ether ist ein Sauerstoffatom, das je eine Einfachbindung zu einem organischen Rest trägt R1-O-R2.
Häufig gestellte Fragen zum Thema Ester









Alle Artikel aus dem Fach Chemie