Hydroxylgruppe – Definition, Eigenschaften, Nachweis
Lerne, dass die Hydroxylgruppe die funktionelle Gruppe von Alkoholen und Phenolen ist und polare Eigenschaften verleiht. Was sind Alkohole und Phenole? Entdecke die Unterschiede in den Eigenschaften und warum Phenole eher sauer sind. Interessiert? Mehr dazu im Text!
Inhaltsverzeichnis zum Thema Hydroxylgruppe
Wie willst du heute lernen?
Bildergalerie zum Thema Hydroxylgruppe
Hydroxylgruppe – Definition

Wird bei einem Kohlenwasserstoffmolekül ein Wasserstoffatom gegen eine Hydroxylgruppe (Hydroxylierung) ausgetauscht, entstehen:
- bei aliphatischen (offenen, kettenartigen) Kohlenwasserstoffen Alkohole,
- bei einem aromatischen (zyklischen) Kohlenwasserstoff Phenole.
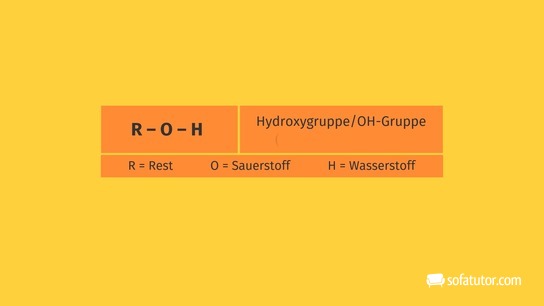
Die Hydroxylgruppe ist also die funktionelle Gruppe der Alkohole und Phenole. Sie wird umgangssprachlich auch als Alkoholgruppe bezeichnet. Je nach der Anzahl der OH-Gruppen werden sie in ein- und mehrwertige Alkohole oder Phenole unterschieden. Die Hydroxylgruppen befinden sich bei den mehrwertigen Verbindungen nicht am gleichen Kohlenstoffatom (Erlenmeyer-Regel), da das Molekül dadurch instabil wird.
Auch in anderen Molekülen kann die ![]() -Gruppe vorkommen, zum Beispiel gibt es Aminosäuren mit Hydroxylgruppen.
-Gruppe vorkommen, zum Beispiel gibt es Aminosäuren mit Hydroxylgruppen.
Hydroxylgruppe der Alkohole – Eigenschaften
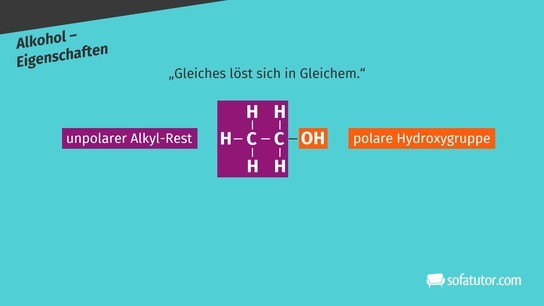
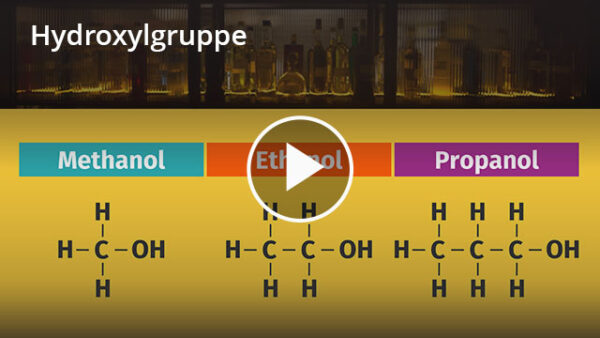
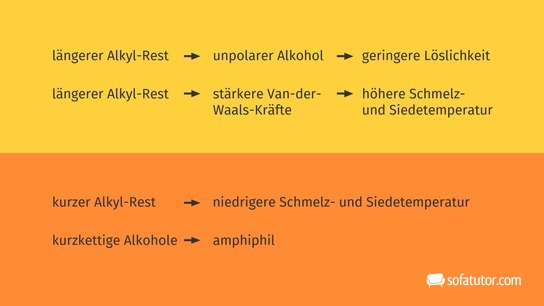
Alkohole ![]() sind organische Verbindungen mit mindestens einer Hydroxylgruppe. Ist der aliphatische Kohlenwasserstoffrest ein Alkan, spricht man auch von Alkanolen. Aliphatische Kohlenwasserstoffreste sind offene Kohlenwasserstoffketten. Ethanol ist ein Beispiel für einen aliphatischen Alkohol mit einer Hydroxylgruppe. Er ist ein bekanntes Beispiel aus dem Alltag und kommt in alkoholischen Getränken vor. Durch die Hydroxylgruppe erhalten Alkohole polare Eigenschaften. Die hydrophile Hydroxylgruppe macht gerade kurzkettige Alkohole gut wasserlöslich. Alkohole sind in der Lage, Wasserstoffbrückenbindungen einzugehen. Daher besitzen beispielsweise Alkanole höhere Schmelz- und Siedepunkte als die entsprechenden Alkane. Kurzkettige Alkohole erhalten durch ihre polare Hydroxylgruppe und ihren unpolaren Alkylrest amphiphilen (wasser- und fettliebend) Charakter und werden gerne als Lösungsmittel eingesetzt. Bei der Reaktion von Alkoholen mit Wasser entstehen Aldehyde oder Ketone. Bei dieser Oxidation wird das Wasserstoffatom der Hydroxylgruppe abgespalten und eine Doppelbindung zum Sauerstoffatom ausgebildet.
sind organische Verbindungen mit mindestens einer Hydroxylgruppe. Ist der aliphatische Kohlenwasserstoffrest ein Alkan, spricht man auch von Alkanolen. Aliphatische Kohlenwasserstoffreste sind offene Kohlenwasserstoffketten. Ethanol ist ein Beispiel für einen aliphatischen Alkohol mit einer Hydroxylgruppe. Er ist ein bekanntes Beispiel aus dem Alltag und kommt in alkoholischen Getränken vor. Durch die Hydroxylgruppe erhalten Alkohole polare Eigenschaften. Die hydrophile Hydroxylgruppe macht gerade kurzkettige Alkohole gut wasserlöslich. Alkohole sind in der Lage, Wasserstoffbrückenbindungen einzugehen. Daher besitzen beispielsweise Alkanole höhere Schmelz- und Siedepunkte als die entsprechenden Alkane. Kurzkettige Alkohole erhalten durch ihre polare Hydroxylgruppe und ihren unpolaren Alkylrest amphiphilen (wasser- und fettliebend) Charakter und werden gerne als Lösungsmittel eingesetzt. Bei der Reaktion von Alkoholen mit Wasser entstehen Aldehyde oder Ketone. Bei dieser Oxidation wird das Wasserstoffatom der Hydroxylgruppe abgespalten und eine Doppelbindung zum Sauerstoffatom ausgebildet.
In der folgenden Tabelle erkennst du die Veränderung der Eigenschaften aufgrund der Einführung der funktionellen Hydroxylgruppe ins Molekül:
| Alkan | Alkanol | |
|---|---|---|
| Beispiel | Ethan |
Ethanol |
| Wasserlöslichkeit | nein | sehr gut |
| Siedetemperatur | niedrig | hoch |
Hydroxylgruppe der Phenole – Eigenschaften
Phenole sind aromatische Verbindungen aus Phenyl- und OH-Gruppen. Bei den Phenolen kann es zur Deprotonierung der OH-Gruppe kommen. Bei der Deprotonierung gibt die Hydroxylgruppe das positiv geladene Wasserstoffatom ab. Phenole sind daher schwache organische Säuren. Die Deprotonierung kommt bei Phenolen viel häufiger vor als bei Alkoholen. Das liegt an der höheren Stabilität des dabei entstehenden Phenolations. Die phenolischen Verbindungen sind mäßig gut wasserlöslich.
In der folgenden Abbildung findest du einige Beispiele für Phenole:

Quelle sofatutor.com
Häufig gestellte Fragen zum Thema Hydroxylgruppe












Alle Artikel aus dem Fach Chemie